(6分) 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,该同位素含有8个中子,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
用①质子数、②中子数、③电子数、④质量数、⑤同位素填空,
请将序号填在后面横线上。
(1)136C与147N具有相同的,(2)136C与126C具有相同的,
(3)146C与147N具有相同的,(4)157N与147N互为。
(1)右图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。计算:(要求写出简要计算过程)用该浓硫酸配制200mL1mol/L的稀硫酸,用量筒所需量取该浓硫酸的体积是多少mL?
(2)在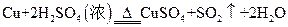 反应中,
反应中,
若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是多少?
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若用nA 代表阿伏加德罗常数的数值,则:(只要求写出结果)
(1)该气体的物质的量为________mol。(2)该气体在标准状况下的体积为_________L。
(3)该气体所含原子总数为_______个。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
欲用36.5%(密度为1.18g/cm3)的浓盐酸配制浓度为1.00mol/L的稀盐酸500mL。

(1)选用的主要玻璃仪器有:①②③④⑤。
(2)现有下列配制操作,正确的操作顺序为:(填字母)
| A.用量筒量取浓盐酸; | B.反复颠倒摇匀; | C.用胶头滴管加水至刻度线; |
| D.洗净所用仪器,洗涤液也转入容量瓶;E.稀释浓盐酸;F.溶液冷却后转入容量瓶。 |
(3)简要回答下列问题:
如果实验室有10mL、50mL、100mL的量筒,应选用mL的量筒。量取时发现量筒不干净,用水洗净后直接量取,将使配制的溶液浓度(填“偏高”、“偏低”或“无影响”)。
(1).现有以下物质①NaCl溶液②干冰③硫酸④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧熔融状态的KNO3,其中属于电解质的是:;属于非电解质的是:;能导电的是:。(均填序号)
(2).选择下列实验方法分离物质,将分离方法的字母填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
①分离粗盐中混有的泥沙______。②分离碘和水的混合物______。
③分离水和汽油的混合物______。④分离酒精和水的混合物______。
(3).离子方程式BaCO3+2H+ ="=" CO2↑+H2O+Ba2+中的H+不能代表的物质是_____________(填序号)①HCl②H2SO4③HNO3④NaHSO4⑤CH3COOH
(4)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液先出现红褐色浑浊,接着红褐色浑浊逐渐变浅,最终又得到黄色的FeCl3溶液,先出现红褐色浑浊的原因:,又得到黄色的FeCl3溶液的化学方程式为:。