下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为 。装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,滥测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入如下物质:
| 选项 |
a |
b |
c |
d |
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
其中,能证明氯气有漂白性的是 (填字母)。
(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(4)装置F中用足量的Na2SO3溶液吸收余氯,试写出相应的离子反应方程式:
某学习小组用如下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。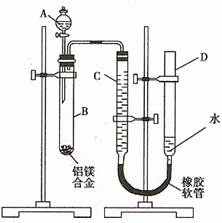
(1)A中试剂为_______________________。
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,
需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是_______________________________(填序号);记录C的液面位置时,除视线平视外,还应_________________________。
(4)B中发生反应的化学方程式为_________________________________________。
(5)若实验用铝镁合金的质量为a g ,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为____________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________________(填“偏大”、“偏小”、“不受影响”)。
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的试验。回答下列问题:
(1)定性分析:如图甲可通过观察,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式:。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的数据是。检查乙装置气密性的方法是。
该图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。(已知一氯乙烷沸点:12.3℃)试回答:
(1)B逸出的主要气体名称__________;
(2)D瓶的作用是___________________;
(3)E管的作用是_____________________;
(4)F管口点燃的气体分子式__________________
(5)A瓶中无水硫酸铜粉末变蓝的原因是______________________________;
(6)A中发生反应的化学方程式:________________________________________________
Ⅰ:元素的金属活动性递变规律是元素周期表学习的重要内容之一。某校研究性学习小组查阅课外资料,看到第IVA族的三种金属锗、锡、铅的性质:“锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,请解释发生上述变化的原因是
。
Ⅱ:另一研究性学习小组欲通过实验探究Zn、Fe、Cu的金属活动性顺序,根据不同的实验条件设计了如下的几种实验方案:
(1)该小组同学根据提供的Zn片、Fe片和稀硫酸,设计成了一个原电池比较锌与铁的活动性顺序,请在下侧方框内画出原电池装置图。并写出正极的反应现象及电极反应式。
现象;电极反应式。
(2)现只有Fe片、CuO和稀硫酸这几种药品,请你帮忙设计方案比较铁与铜的活动性顺序。你的设计方法是
某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中有机反应的化学方程式________________________________
(2)已知上述反应是放热反应。观察到A中的现象是_______________________________
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___________________,写出有关的化学方程式________________________________。
(4)C中盛放CCl4的作用是___________________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。