经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的试验。回答下列问题:
(1) 定性分析:如图甲可通过观察 ,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式: 。
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。检查乙装置气密性的方法是 。
某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。
(1)连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?_______________________________________________________________。
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有(写化学式)。
能证明分解产物中有CO气体生成的实验现象是。
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是,现象是。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为(写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式。
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是。
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
⑵“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是。
②滴定终点的实验现象为。
⑶味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,(填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L—1的AgNO3溶液,再加入少量溶液做指示剂,用浓度为c2mol·L—1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是。
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 |
V (Na2CO3)/ mL |
沉淀情况 |
编号 |
反应温度/℃ |
沉淀情况 |
|
| 1 |
2.8 |
多、蓝色 |
1 |
40 |
多、蓝色 |
|
| 2 |
2.4 |
多、蓝色 |
2 |
60 |
少、浅绿色 |
|
| 3 |
2.0 |
较多、绿色 |
3 |
75 |
较多、绿色 |
|
| 4 |
1.6 |
较少、绿色 |
4 |
80 |
较多、绿色(少量褐色) |
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是。
②80℃时,所制得的孔雀石有少量褐色物质的原因是。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验: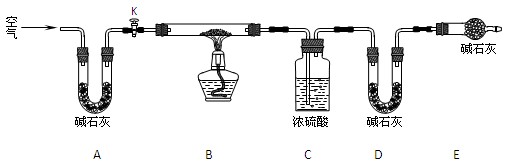
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:。
步骤5:称量相关装置的质量。
①装置A的作用是;若无装置E,则实验测定的x/y的值将(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的(写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式。
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是;
(2)实施滴定的溶液以呈(选填“酸性”、“中性”或“碱性”)为宜,加
(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果(选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为。
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
 II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为(填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为(填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是(填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为。