醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
实验室中用含少量CO2杂质的CO来还原铁的氧化物FexOy并证明CO能够还原FexOy,且本身被氧化为CO2,实验所提供的各种仪器和药品如下:
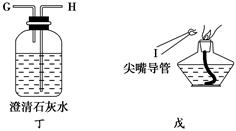
(1)实验时,上述仪器装置的正确连接顺序是(填写各接口的代号)。混合气体―→________,________接(F),(E)接________,________接________,________接________。
(2)在装置乙中发生反应的化学方程式是_______________________。
(3)在装置甲中发生反应的化学方程式是______________。
(4)丙装置中澄清石灰水的作用是_______________。
(5)经定量测定,0.4 g FexOy与CO反应生成的气体通入过量的澄清石灰水中,生成0.75 g白色沉淀,则FexOy中x值是________,y值是________。
(6)实验过程中,能说明CO能够还原FexOy的实验现象是___________。能够说明CO被氧化成CO2的实验现象是____________。
2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____________。
(2)需要加热的装置是____________(填字母代号)。
(3)装置D的作用是_________________________________。
(4)F处读数时应该注意:____________、____________。
(5)三聚氰胺的分子式为_________________。
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
(1)A的结构式为____________,B中决定性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________,反应类型:____________。
②_____________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?________________。
(4)在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________________;
该装置图中有一个明显的错误是______________________________。
经测定乙醇的化学式是C2H6O,由于有机物普遍存在的同分异构现象,推测乙醇的结构可能是下列两种之一。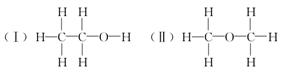
为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四名同学直接利用如图给定装置进行实验确定乙醇的结构。
(1)学生甲得到一组实验数据:
| 乙醇的物质的量(mol) |
氢气的体积(L) |
| 0.10 |
1.12(标准状况) |
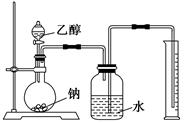
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由为_______________。
(2)同学乙分别准确称量4.60 g乙醇进行多次实验,结果发现以排到量筒内的水的体积作为生成的H2体积换算成标准状况后都小于1.12 L,如果忽略量筒本身及乙读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”)如果你认为正确,请说明理由,如果你认为不正确,那产生这种情况的原因应该是什么?________________。
(3)同学丙认为实验成功的关键有:①装置气密性要良好
②实验开始前准确确定乙醇的量 ③钠足量 ④广口瓶内水必须充满 ⑤氢气体积的测算方法正确、数据准确。其中正确的有________。(填序号)
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是_____________。
(5)实验后,四名同学从乙醇的可能结构分析入手对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是_________________。