采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:

其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. | ν(第一步的逆反应P>ν(第二步反应) |
| B. | 反应的中间产物只有 |
| C. | 第二步中 与 的碰撞仅部分有效 |
| D. | 第三步反应活化能较高。 |
回答实验室配制0.1 mol/L的NaOH 溶液480 mL实验中的下列问题。
(1)需NaOH g。
(2)有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒 ⑥托盘天平。
配制时,必须使用的仪器有 ,还缺少的仪器是 。
(3)下列称量NaOH 的操作中,正确的是 (填序号,下同)
①把NaOH直接放在托盘上称量 ②把NaOH放在纸上称量
③把NaOH放入烧杯中称量
(4)使用容量瓶前必须进行的一步操作是 。
(5)配制过程中,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度
四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡。已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室可用下列装置合成四氯化锡(夹持装置略)。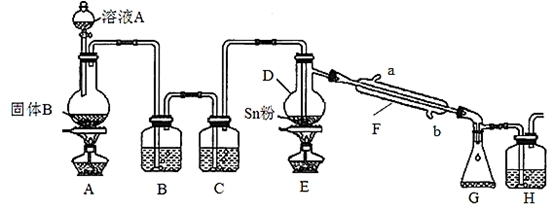
(1)装置D的名称为 ;
(2)冷凝水应从 (填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为 ;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为 ;
(5)装置E中加热的目的是 、 ;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为 。
(7)该实验装置存在设计缺陷,你的改进措施为 。
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20 g SnCl4,则SnCl4的产率为 (已知SnCl4相对分子质量为261)。
乙醇氧化后可生成乙醛,某研究性学习小组的同学通过查阅资料获得信息:
①乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃;
②久置的乙醛水溶液会产生分层现象,下层为水溶液,上层无色油状液体为乙醛的环状聚合物(C2H4O)n,该聚合物的沸点比水的沸点高,分子中无醛基;
③利用反应:(C2H4O)n nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
根据上述信息,用如图装置提取乙醛,请回答下列问题:
(1)写出乙醇氧化成乙醛的化学方程式: ;
(2)将混合物加热至沸腾,(C2H4O)n缓缓分解,把生成的气体导入锥形瓶中:
①若实验过程中不使用冷凝管冷却,随着蒸发的进行,溶液中有黑色物质和刺激性气味气体生成。用化学方程式表示这一现象: ;
②当锥形瓶内导管口气泡越来越少时,表明大部分乙醛已蒸出,实验结束。拆除实验装置的第一步操作是: ;
(3)当n=3时,试写出(C2H4O)n的结构简式 ;
(4)设计一简单实验证明久置的乙醛是否被氧化(写出简要操作步骤、使用的试剂、实验现象和结论): 。
(14分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 分组实验 |
催化剂 |
|
| ① |
10mL 5% H2O2溶液 |
无 |
| ② |
10mL 2% H2O2溶液 |
无 |
| ③ |
10mL 5% H2O2溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ④ |
10mL 5%H2O2溶液+少量HCl溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ⑤ |
10mL 5% H2O2溶液+少量NaOH溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: 环境能增大H2O2分解的速率; 环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)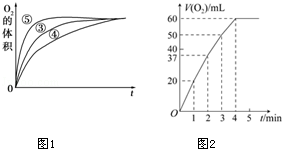
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】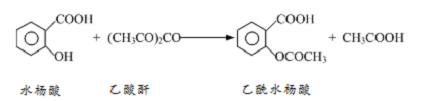
【物质性质】
【实验流程】
(1)物质制备:向大试管中依次加入2 g水杨酸、5 mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10 min。装置如下图: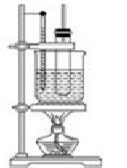
(2)产品结晶:取下大试管,置于冷水中冷却10 min。待晶体完全析出,……抽滤,再洗涤晶体,抽干。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸1.8 g。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。
【问题讨论】
1、写出水杨酸与碳酸氢钠溶液反应的化学反应方程式 。
2、写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式 。
3、流程(1)装置图中长导管的作用 。
4、控制反应温度85℃~90℃的原因 。
5、流程(2)中证明晶体洗涤干净的操作方法: 。
6、流程(4)中溶液显紫色,可能的原因是 。
7、1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗 mol NaOH。
8、实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。