乙醇氧化后可生成乙醛,某研究性学习小组的同学通过查阅资料获得信息:
①乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃;
②久置的乙醛水溶液会产生分层现象,下层为水溶液,上层无色油状液体为乙醛的环状聚合物(C2H4O)n,该聚合物的沸点比水的沸点高,分子中无醛基;
③利用反应:(C2H4O)n nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
根据上述信息,用如图装置提取乙醛,请回答下列问题:

(1)写出乙醇氧化成乙醛的化学方程式: ;
(2)将混合物加热至沸腾,(C2H4O)n缓缓分解,把生成的气体导入锥形瓶中:
①若实验过程中不使用冷凝管冷却,随着蒸发的进行,溶液中有黑色物质和刺激性气味气体生成。用化学方程式表示这一现象: ;
②当锥形瓶内导管口气泡越来越少时,表明大部分乙醛已蒸出,实验结束。拆除实验装置的第一步操作是: ;
(3)当n=3时,试写出(C2H4O)n的结构简式 ;
(4)设计一简单实验证明久置的乙醛是否被氧化(写出简要操作步骤、使用的试剂、实验现象和结论): 。
实验室现有一瓶含少量氯化钙的氯化钾,通过下面的实验制取纯净的氯化钾,根据实
验步骤填写下列空白。
(1)加入的A是,检验A是否过量的方法是。
(2)操作a是,用到的玻璃仪器有、 、 。
(3)溶液中加入的B物质是,应加入过量B物质的理由是。
(4)操作b是,其中用到与操作a相同的玻璃仪器是,该仪器在此处的作用是。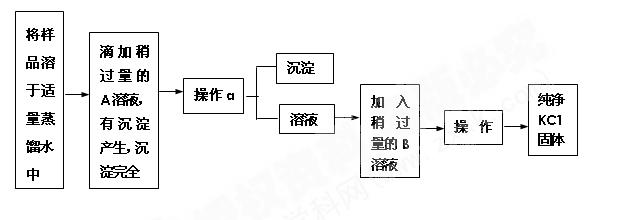
实验室配制100ml 0.2mol/L的NaCl溶液
(1)本实验所需的仪器为(填序号)②
①量筒②托盘天平③烧杯④漏斗⑤250ml 容量瓶⑥ 100ml容量瓶⑦药匙⑧胶头滴管
除上述仪器中可使用的以外,还缺少的仪器。它在该实验中的用途中
①。②。
(2)在使用容量瓶之前必须进行的操作是:在容量瓶中标有①温度,②,③三个特征标志。
(3)请写出该实验的实验步骤。
①计算,②称量,③,④,⑤,⑥定容。
(4)在实验过程中出现如下情况应该该如何处理
①加蒸馏水时不慎超过刻度线应。
②加蒸馏水到刻度线以下1cm至2cm处应
③向容量瓶中倾倒溶液时应
某学生设 计了如下实验:
计了如下实验:
(1)该同学的实验目的是_____________________________;
(2)上图③操作步骤为________________,④加入试剂为;
(3)按此实验方案得到的NaCl固体中肯定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。
某无色溶液可能由KNO3、NH4Cl、Na2CO3、CaCl2中的一种或 几种混合而成。往溶液中加入烧碱溶液并微热,则放出能使湿润的红色石蕊试纸
几种混合而成。往溶液中加入烧碱溶液并微热,则放出能使湿润的红色石蕊试纸 变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
实验室制配0.5 mol/L的NaOH溶液500 mL,完成下列实验并回答问题。(每空2分)
⑴配制时,一般可分为以下几个步骤,请填空:
①计算:计算实验需要的NaOH固体质量为g;
②称量:用小烧杯和托盘天平迅速准确称量所需的NaOH固体
③溶解:往装有NaOH的小烧杯中加入适量的水溶解,冷却至室温
④转移:将上述冷却后的溶液转入500mL的容量瓶
⑤洗涤:用蒸馏水洗涤小烧杯和玻璃棒2-3次,将洗涤液一并注入容量瓶,轻轻摇动使混合均匀
⑥定容:在容量瓶中继续加水至距刻度线1-2cm处,改用(仪器名称)滴加至凹液面与刻度线相切
⑦摇匀:把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀
⑵容量瓶在使用前,必须进行的操作是:。
⑶实验两次用到玻璃棒,其作用分别是: 、 。
⑷试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“无影响” )
①定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响___。
②某同学定容时俯视刻度线,则所配制的溶液的浓度_________。
③NaOH溶解后未冷却立即转移到容量瓶中并洗涤定容,则所配制的溶液浓度。