(16分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):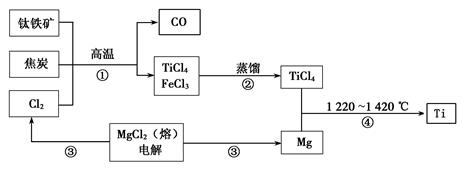
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2高温2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为____________,该反应在氩气中进行的理由是____ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有__________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s) +2Cl2 (g) TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中碳块为阳极,电极反应式为:2O2ˉ4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号) 。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是 。
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、 、
、 、
、 等含一个碳原子的物质为原料合成工业产品的化学与工艺。
等含一个碳原子的物质为原料合成工业产品的化学与工艺。
(1)将 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a.
b.
c.
d.
在以上属于人工转化的反应中,原子利用率最高的是 (填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入 和
和 ,在催化剂作用下合成甲醇:
,在催化剂作用下合成甲醇:

 。平衡时CO的转化率与温度、压强的关系如图。
。平衡时CO的转化率与温度、压强的关系如图。
①该反应属于 反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数 值很大,对此反应的说法正确的是 (填序号)。
值很大,对此反应的说法正确的是 (填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
② 时,该反应的平衡常数
时,该反应的平衡常数 (用
(用 的代数式表示)。
的代数式表示)。
(3)二甲醚( )被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.



b.



c.



总反应:

 的
的 。
。
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母)。
a.
b.容器内压强保持不变
c. 的浓度保持不变
的浓度保持不变
d. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为 。
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、 等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO
等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO )在有催化剂的条件下反应的化学方程式 。
)在有催化剂的条件下反应的化学方程式 。
(8分)(1)有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol·L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如右图所示。请回答下列问题: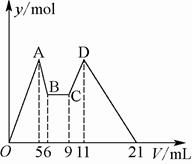

①上述 HCl溶液的浓度c= mol/L。
②所加NaOH溶液的体积为( )
| A.9 mL | B.7.5 mL | C.7 mL | D.6 mL |
(2)向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。(已知氧化性:Br2> Fe3+>I2)请回答下列问题:
① 原混合液中n(FeBr2)= mol ;
原混合液中n(FeBr2)= mol ;
②a值等于 。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是
①________ ,②________ ,③________ ,④_______ _。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① |
实验② |
实验③ |
|
| 取甲瓶溶液的量 |
400 mL |
120 mL |
120 mL |
| 取乙瓶溶液的量 |
120 mL |
440 mL |
400 mL |
| 生成沉淀的量 |
1.56 g |
1.56 g |
3.12 g |
①甲瓶溶液为_______ _ 溶液。
②乙瓶溶液为________ 溶液,其物质的量浓度为________mol·L-1。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Li+、K+、Cu2+、Ba2+、Al3+ 和五种阴离子X、Cl-、OH-、NO3—、CO32—中的一种。已知E是LiCl。
(1)某同学通过比较分析,认为无须检验就可判断其余的四种物质中必有的两种物质是 和 (填对应物质的化学式)。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为 (填序号)。
①Br-②SO42—③CH3COO-④HCO3—
(3)将19.2g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 ,若要Cu完全溶解,至少加入H2SO4的物质的量是 mol。