(15分)(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO  2CO2+N2
2CO2+N2
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中:
| 实验编号 |
T/℃ |
NO初始浓度mol/L |
CO初始浓度mol/L |
催化剂的比表面积m2/g |
| Ⅰ |
280 |
1.2×10-3 |
5.8×10-3 |
82 |
| Ⅱ |
|
|
|
124 |
| Ⅲ |
350 |
|
|
124 |
①请在表格中填入剩余的实验条件数据。
②设计实验Ⅱ、Ⅲ的目的是 。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质。某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程。提供的装置: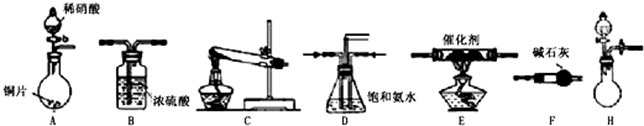
步骤一、NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是: (填装置序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
| 试剂组合序号 |
固体试剂(g) |
NH3体积(mL) |
|
| a |
12.0g Ca(OH)2(过量) |
10.8g NH4Cl |
2688 |
| b |
10.8g (NH4)2SO4 |
2728 |
|
| c |
12.0g NaOH(过量) |
10.8g NH4Cl |
3136 |
| d |
10.8g (NH4)2SO4 |
3118 |
|
| e |
12.0g CaO(过量) |
10.8g NH4Cl |
3506 |
| f |
10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是 (填序号),其它组合 NH3产率不高的原因是 。
步骤二、模拟尾气的处理选用上述部分装置,按下列顺序连接成模拟尾气处理装置: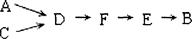
①A中反应的离子方程式: 。
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是: 。
③D装置中的液体可换成 (填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是: 。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含离子,其物质的量浓度为。
(3)由第三份进行的实验可知12.54g 沉淀的成份为。请计算形成该沉淀的原混合物中各离子的物质的量。
(4)综合上述实验,你认为以下结论正确的是()
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
(7分)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、渗析、加热分解等。下列各组混和物的分离或提纯,应采用什么方法或加何种试剂:
(1)除去乙醇中溶解的食盐,方法是________________。
(2)除去Ca(OH)2溶液中悬浮的CaCO3颗粒用________操作。
(3)除去KCl溶液中的SO42-,依次加入的溶液为(填化学式):________、________、________。
(4)用食用酒精浸泡中草药提取其中的有效成分,其过程称________;从碘水中提取碘采用________操作。
(15分:除注明分数的小题之外,其余为1分))
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空: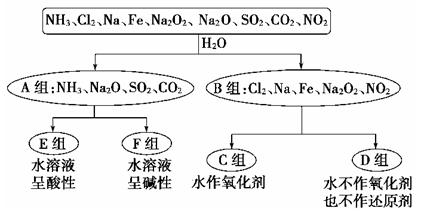
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:___。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。
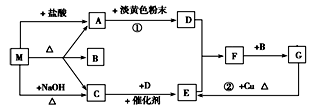
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_________________________________________。
(4)F→G的化学方程式___________________________________________。
(12分:除注明分数的小题之外,其余为1分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.FeB.FeCl3C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是______________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)=mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③___________④____________
B请写出通入⑥的化学方程式__________________________________
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液体积/mL |
HCl溶液体积/mL |
| 1 |
25.00 |
24.41 |
| 2 |
25.00 |
24.39 |
| 3 |
25.00 |
24.60 |
回答下列问题:
(1)图中甲为滴定管(填“酸式”或“碱式”)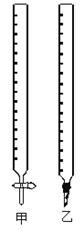
(2)①配制标准盐酸时,不需要用到的仪器是________;
A.托盘天平
B.容量瓶
C.酸式滴定管
D.量筒
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,眼睛要___________________。
(3)取待测液NaOH溶液25.00mL 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是_________
(4)若酸式滴定管不用标准盐酸润洗,将使所测结果(填“偏高”“偏低”“不变”,下同);若读数时,滴定前仰视,滴定后正确读数,则所测结果。
(5)未知浓度的NaOH溶液的物质的量浓度为mol/L。