为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如下: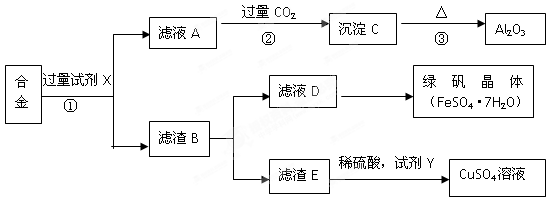
(1)写出反应①的离子方程式 。
(2)步骤②中通入过量的CO2时生成沉淀的化学方程式为 。
(3)检验滤液D是否含有Fe3+的最佳试剂为 (填序号)
A、KMnO4 B、NaOH C、氯水 D、KSCN
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
(5)试剂Y应该是一种 (填“氧化剂”或“还原剂”),它不可能是
A、H2O2 B、铁单质 C、O2
(16分) 化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
(1)写出A含有官能团的名称:;
(2)H可能是(写名称):________________________________________________ __;
(3)写出②、③的反应类型:②__________________、③__________________;
(4)写出E、G的结构简式EG;
(5)反应⑤的化学方程式:
(6)同时满足下列条件的C的同分异构体有_________ 种:
①能发生银镜反应;②1mol该物质可以消耗3molNaOH; ③苯环上的一氯代物有3种。
(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
| 阳离子 |
Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___________________。
用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题:
(1)实验室保存饱和氯水的方法是___________________________________________。
(2)产生上述现象的原因可能有两种(用简要文字说明)
①是由于_______________________________________________________________;
②是由于_____________________________________________________________。
简述怎样用实验证明红色褪去的原因是①或者是②:_______________________
________________________________________________________________________。
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:________________
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| 试剂 |
离子反应方程式 |
|
| ①NaHCO3溶液(Na2CO3) |
||
| ② Fe2O3(Al2O3) |
||
| ③FeCl3溶液(FeCl2) |
||
| ④CO2(HCl) |
石墨的片层结构如图所示,试回答: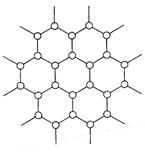
(1)平均个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与碳一碳化学键之比是。
(3)ng碳原子可构成个正六边形。