煤、石油和天然气等化石燃料是目前人类使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有
(2)化石燃料属于
(3)工业上,煤炭燃烧前进行粉碎的目的是
方案I 取8.00
赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60
滤渣。则赤铁矿粉中氧化铁的质量分数为
方案Ⅱ 如图所示,取8.00
赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32
。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应
↑计算,赤铁矿粉中氧化铁的质量分数为

[实验反思]方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,这会导致测出的氧化铁的质量分数
[实验分析]方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是
某同学对某地工业废水(含有硫酸和盐酸)中的H2SO4进行测定.取50g该废水于烧杯中,加入足量的BaCl2溶液,充分反应中,过滤、洗涤、干燥得到BaSO4固体11.65g.通过计算回答下列问题:
(1)50g该废水中H2SO4的质量
(2)若改用KOH溶液来测定50g该废水中H2SO4的含量,结果会 (填“偏高”、“偏低”、“不变”),理由是 .
鸡蛋壳的主要成分是磷酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g放在烧杯里,然后往烧杯中加入足量的稀盐酸90g,充分反应后,称得反应剩余物为97.14g.(假设其他物质不与盐酸反应)
(1)产生二氧化碳气体 g.
(2)计算该鸡蛋壳中碳酸钙的质量分数.
化学兴趣小组为了测定石灰石中碳酸钙的质量分数(杂质不溶于水,也不与盐酸反应).测得的数据如下:
| 实验组次 |
1 |
2 |
3 |
4 |
| 样品质量/g |
30 |
20 |
20 |
30 |
| 稀盐酸的质量/g |
50 |
50 |
100 |
100 |
| 产生气体的质量/g |
6.6 |
6.6 |
6.6 |
m |
(1)m的值为多少?
(2)第 组实验恰好完全反应?
(3)该石灰石样品的纯度是多少?
为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答: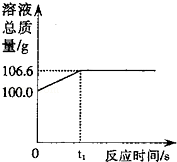
(1)赤铁矿石中所含主要物质的颜色为: .
(2)实验中多余的一氧化碳能否用水吸收? .
(3)上述反应中产生二氧化碳的质量为 g.
(4)计算实验结束后所得不饱和溶液中所含溶质的质量.
某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸49t(H2SO4的质量分数为10%),与足量废铁屑起反应,可生产硫酸亚铁的质量是多少?