某兴趣小组同学电池中物质的成分,将电池剥开时闻到异味且发现有黑色物质。
【提出问题】为什么有异味?黑色物质的成分是什么?
【网络搜索】干电池成分有二氧化锰、铁粉及铵盐等物质;
【实验探究】同学们分别设计实验进行探究。
实验Ⅰ.小婧取适量黑色物质与 混合置于研钵内研磨,听嗅到氨味,再用湿润的红色石蕊试纸检测,试纸变蓝,证明黑色物质中含有铵盐。
实验Ⅱ.小清用一种物理方法发现黑色物质中不含铁粉,他采用的方法是 ;
实验Ⅲ.小明将黑色物质加入适量的水中搅拌,静置后过滤,取滤渣进行实验。
| 实验步骤 |
实验现象 |
实验结论 |
| ①将适量黑色滤渣装入试管中,再加入过氧化氢溶液 |
|
有气体生成 |
| ②立即向上述试管中 |
木条复燃 |
该气体是氧气 |
上述实验中产生氧气的化学方程式为 ,据此小明认为黑色物质中一定含有二氧化锰。
【交流讨论】大家对小明的结论提出了质疑。
(1)小莹认为若要证明黑色物质中一定含有二氧化锰,必须验证二氧化锰的质量和 在反应前后都没有发生变化;
(2)小仪认为除了小莹考虑的因素外,另一个原因是氧化铜等黑色物质对过氧化氢分解有催化作用。
【结论与反思】(1)干电池中一定含有铵盐,可能含有二氧化锰,一定不含有铁粉。
(2)面对网络信息,我们要去伪存真,不应盲从。
甲、乙两位同学分别用如图所示装置进行实验。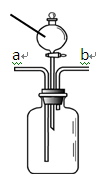
(1)甲同学验证燃烧的条件。取一小块白磷放入广口瓶中,一段时间白磷没有燃烧,然后从分液漏斗中加入适量的________,白磷仍然没有燃烧,再从a管通入________,白磷发生燃烧,该实验________(填“能”或“不能”)证明可燃物燃烧需要与氧气接触、温度达到着火点这两个条件。
(2)乙同学验证二氧化碳与水的反应。为验证使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是________(填序号,可重复选用)。
① 从b端通氮气② 从分液漏斗中滴加适量水
③ 从a端通二氧化碳④ 将石蕊溶液染成紫色的干燥纸花放入广口瓶中
某活动小组根据下图所示进行模拟炼铁的实验,并对产物的成分进行探究。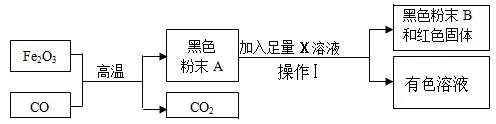
【提出问题】黑色粉末A可能是什么呢?
【查阅资料】小华查阅资料,得到关于铁的氧化物如下信息:
| 铁的氧化物 |
Fe2O3 |
Fe3O4 |
FeO |
| 颜色 |
红 |
黑 |
黑 |
| 物理性质 |
不能被磁铁吸引 |
能被磁铁吸引 |
不能被磁铁吸引 |
| 化学性质 |
可溶于酸 |
常温下不溶于稀酸 |
可溶于酸,但不生成气体 |
【提出猜想】(1)小明认为黑色粉末A全部是铁粉。为了证明自己的猜想小明设计了如上图的实验,该实验中,小明加入的X溶液是;实验过程中操作Ⅰ是这个实验基本操作。
小华根据小明的实验认定小明的猜想是错误的,理由是。
(2)小华根据资料提出了自己的两个猜想,请结合所学知识补充余下的一个猜想。
猜想①:黑色粉末A由铁粉和四氧化三铁(Fe3O4)组成
猜想②:黑色粉末A由铁粉和氧化亚铁(FeO)组成
猜想③:
【实验探究】
| 方案 |
实验操作 |
可能的现象 |
结论 |
| ① |
取适量黑色粉末A 用磁铁吸引 |
猜想①正确 |
|
| ② |
适量黑色粉末A 用磁铁吸引 |
黑色粉末部分被吸引 |
猜想②正确 |
| ③ |
猜想③正确 |
【反思评价】小娟认为方案②中得出的结论不正确,其理由是。
【得出结论】黑色粉末A是铁和氧化亚铁的混合物。
小华想测定黑色粉末A中铁的质量分数,设计了如下实验:
取8g黑色粉末A加入50g足量的稀硫酸,充分反应后称量,剩余物质的质量为57.8g,则该黑色粉末A中铁的质量分数是多少?(写出计算过程)
类比法是化学研究物质的重要方法之一。草酸(H2C2O4)的化学性质与碳酸相似,在受热条件下也会分解。某校研究性学习小组对此展开探究:
⑴小明首先根据草酸中含有元素,可推测生成物中含有水。
⑵小明对分解生成的其他产物进行猜测、验证:
【假设一】生成物中有二氧化碳
实验一:将生成的气体通入,实验现象是,小明据此判断生成物中含有二氧化碳。
【假设二】生成物中有一氧化碳
实验二:小明用如图装段进行实验,从而证明生成物中含有一氧化碳。
请回答:A装置中红棕色固体粉末是(填化学式),A装置中的实验现象是,请写出反应方程式:。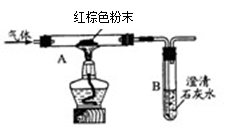
⑶讨论交流:小芳认为,从环保的角度看,“实验二”装置有一个缺陷,请你指出该缺陷:
,处理的方法是。
(4)根据上述探究结果,请写出草酸受热分解的方程式。
下图A、B、C是实验室制备某些常见气体的发生装置示意图。
(1)写出图中标号仪器的名称:a,b。
(2)A可用作实验室制取氧气的发生装置,化学方程是。
(3)B可用作实验室制取二氧化碳的发生装置,化学方程是。
(4)某同学在装置B的基础上,增加了隔离铜网和止水夹等改成装置C来制取二氧化碳,装置 C与B相比,优点是。
.(9分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。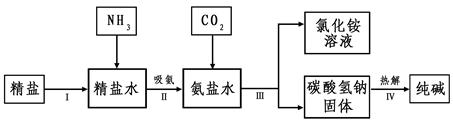
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。