下列实验操作能达到其对应目的的是
| 编号 |
实验操作 |
目的 |
| A |
向2 mL l mol·L-1NaOH溶液中先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1 FeCl3溶液 |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| B |
向淀粉溶液中加入稀硫酸,水浴加热一段时间后,再加入氢氧化钠溶液至溶液呈碱性,最后加入新制的氢氧化铜并加热 |
验证淀粉已水解 |
| C |
将1 mL KSCN溶液与1 mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液 |
证明溶液中存在平衡: Fe3++3SCN-  Fe(SCN)3 Fe(SCN)3 |
| D |
将乙醇与浓硫酸共热制得的气体,直接通入溴水中 |
检验产物是乙烯气体 |
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2( g ) + 3H2( g ) = 2NH3( g ) ΔH="—92.4" KJ/mol,则N≡N键的键能是
| A.431 KJ/mol | B.946 KJ/mol | C.649 KJ/mol | D.869 KJ/mol |
下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
| A.26.0 kJ | B.51.9 kJ | C.155.8 kJ | D.467.3 kJ |
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
| A.一定大于92.0 kJ | B.一定等于92.0 kJ |
| C.一定小于92.0 kJ | D.不能确定 |
已知
(l)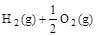 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)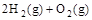 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)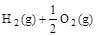 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
(4)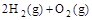 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |