X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的最高价氧化物对应的水化物的化学式为H2XO3 |
| Y |
Y是地壳中含量最高的元素 |
| Z |
Z元素的最外层电子数与电子层数相同 |
| W |
W的一种核素的质量数为28,中子数为14 |
(1) W位于元素周期表第 周期第 族;Z的离子结构示意图:_____________
四种元素的原子半径从大到小的顺序为:__________________________(用元素符号表示)
(2)氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 _____________
W的最高价含氧酸钠盐显_____性(填“酸”、“碱”或“中”),其用途是__________________
(4)常温下,不能与z单质发生反应的是_________(填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH e.Na2CO3固体
在25°、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,Z的燃烧热的热化学方程式是 _________________________________。
某同学在画某种元素的一种单核微粒的原子结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是__________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是__________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是__________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是__________。


(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的____________,请写出元素在元素周期表中的位置与元素原子结构的关系:__________________________。
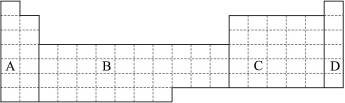
(1)在上面元素周期表中全部是金属元素的区域为____________。
a.A b.B c.C d.D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是____________。
(3)现在甲、乙两种短周期元素,在室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素比较,金属性较强的是____________(填名称),可以验证该结构的实验是____________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别与同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
A、B、C、D、E、F为原子序数由小到大的同周期的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物两两之间皆能反应,均能生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A___________,D___________,E___________。
(2)B的单质在F的单质中燃烧的现象是_________________________,反应的化学方程式是__________________________。
(3)A、C两种元素最高价氧化物对应水化物反应的离子方程式是________________。
下表是元素周期表的一部分。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 1 |
① |
||||||
| 2 |
② |
③ |
④ |
⑤ |
⑥ |
||
| 3 |
⑦ |
⑧ |
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为________,此氢化物的还原性比元素⑨的氢化物的还原性________(填“强”或“弱”)。
(2)俗称为“矾”的一类化合物通常含有的共同元素是____________。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的化学方程式_____________________。又如表中与元素⑦的性质相似的不同族元素是____________(填元素符号)。