化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
① N2的电子式为 。
②上述反应离子方程式为___________________________________________________,
其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。
电源正极为______________(填“A”或“B”),
阴极反应式为_____________________________________。 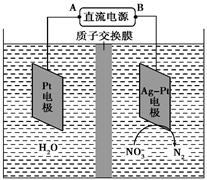
由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料,H可以发生银镜反应。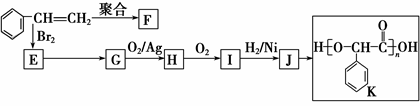
(1)J中所含官能团的名称为________;K中所含官能团的结构简式为______________。
(2)聚合物F的结构简式是___________________;I的分子式是_______________。
(3)E转化为G的化学方程式是__________________________________________;
反应类型属于________________________________。
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式_______。
(5)写出J的一种符合下列条件的同分异构体X的结构简式_____________________。
①X与FeCl3溶液反应显色;
②X分子中氢原子核磁共振氢谱有4个峰。
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
(1)B的结构简式是 ;E中含有的官能团名称是 。
(2)由C和E合成F的化学方程式是 。
(3)同时满足下列条件的苯的同分异构体的结构简式是 。
①含有3个双键;
②核磁共振氢谱只显示1个吸收峰;
③不存在甲基。
(4)乙烯在实验室可由 (填有机物名称)通过 (填反应堆类型)制备。
(5)下列说法正确的是 。
a.A属于饱和烃b.D与乙醛的分子式相同
c.E不能与盐酸反应d.F可以发生酯化反应
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
已知:
请写出NO与CO反应生成无污染气体的热化学方程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温”、“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。
合成治疗脑缺血的药物I的一种路线如下:
已知:
①
②I结构中分别有一个五原子环和一个六原子环。
③F能发生银镜反应。
完成下列填空:
(1)D→E的反应类型为______;F中不含氧的官能团有_________(写名称)。
(2)按系统命名法,A的名称是_______;I的结构简式为__________。
(3)H在一定条件下可以合成高分子树脂,其化学方程式为_____________________。
(4)G的同分异构体有多种,其中含有酚羟基,且结构中有4种不同性质氢的结构有_____种。
(5)化合物D经下列步骤可以得到苯乙烯:
反应Ⅰ的条件为________________;试剂X是_______________;
反应Ⅱ的化学方程式为___________________________________。