现在同学们学过了取代反应、加成反应,请将下列物质发生的反应填写在下表中。①由乙烯制1,2-二氯乙烷;②乙烷与氯气光照;③乙烯使溴的四氯化碳溶液褪色;④乙烯通入酸性高锰酸钾溶液;⑤由苯制取溴苯;⑥乙烷在空气中燃烧;⑦由苯制取硝基苯;⑧由苯制取环己烷
| 反应类型 |
取代反应 |
加成反应 |
| 反应 |
|
|
有四种无色液体:60%的酒精、福尔马林、甲酸和醋酸。只使用一种试剂M鉴别它们,其鉴别过程如下: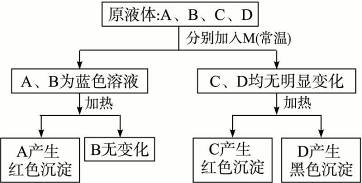
(1)试填写A—D所含有机物的结构简式。
A:______________,B:_______________,C:_______________,D:______________。
(2)试剂M的化学式:______________________________。
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1molNaHCO3能完全反应,则A的结构简式是。
写出与A具有相同官能团的A的所有同分异构体的结构简式______________。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是___________。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是_______________________________________________________________________________
萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等):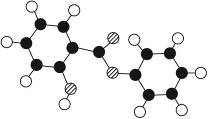
(1)根据上图模型写出萨罗的结构简式:___________。
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)
__________________________________________________________________________
(3)同时符合下列要求的水杨酸的同分异构体共有种。
①含有苯环;②能发生银镜反应;③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH反应;④只能生成两种一氯代物。
(4)从(3)确定的同分异构体中任选一种,指定为下列框图中的A。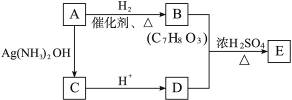
写出下列两个反应的化学方程式(水杨酸用结构简式表示),并指出相应的反应类型。
①A→B_____________________________________________________________________
反应类型_________。
②B+D→E___________________________________________________________________
反应类型_________。
(5)现有水杨酸与苯酚的混合物,它们的物质的量之和为nmol。该混合物完全燃烧消耗O2aL,并生成bgH2O,cLCO2(气体体积均为标准状况下的体积)
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)
__________________________________________________________________________
__________________________________________________________________________
②设混合物中水杨酸的物质的量为xmol,列出x的计算式。
有机物A的结构简式为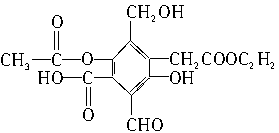
(1)A与过量NaOH完全反应时,A与参加反应的NaOH物质的量之比为____________。
(2)A与新制Cu(OH)2完全反应时,A与参加反应的Cu(OH)2物质的量之比为_________,其中A与被还原的Cu(OH)2的物质的量之比为__________。
(3)A与过量NaHCO3完全反应时,A与参加反应的NaHCO3物质的量之比为___________。
在浓硫酸催化下,某羧酸8.6g完全酯化需乙醇4.6g,此羧酸能与溴发生加成反应,此羧酸是()
| A.CH3CH="=CHCOOH" | B.CH3CH2CH2COOH |
C.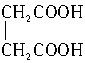 |
D.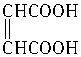 |