下列液体混合后,常温下溶液一定呈碱性的是
| A.pH=8的氢氧化钠溶液1mL与999mL水混合 |
| B.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 |
| C.pH=2的盐酸与0.01mol/L的氨水等体积混合 |
| D.1×10?3mol/L的盐酸和6×10?4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是
| A.前者减少后者不变 | B.前者减小后者增大 | C.都不变 | D.都减小 |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是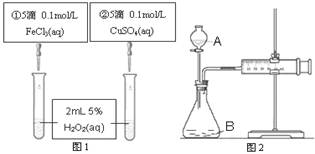
| A.图2中的A为分液漏斗 |
| B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率 |
| C.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好 |
| D.图1实验可通过观察产生气泡的快慢来比较反应速率 |
常温下,将pH=5的硫酸溶液稀释到原来的500倍,则稀释后溶液中SO42-与H+的物质的量浓度之比约为
| A.10∶1 | B.1∶10 | C.1∶2 | D.1∶1 |
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH  CH3COO-+H+。要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+。要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |