(15分) I.工业上用CO生产燃料甲醇。一定条件下发生反应:co(g)+2H2(g) CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
请回答下列问题。
(1)下列说法正确的是 (填字母序号)。
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,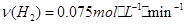
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H2,再次达到平衡时 的值会变小
的值会变小
(2)该温度下CO(g)+2H2 (g)  CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”“减小”或“不变”)。
(3)请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲
线,要求画出压强不同的两条曲线(在曲线上标出P1、P2且P1<P2)。
(4)已知CH3OH(g)+3/2 O2(g)="===" C02(g)+2H2O(g) △H=-192.9kJ/mol,又知H20(1)=====H2O(g)
△H= +44kJ/mol,请写出32g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式
II.已知:在25℃时,H20 H+ + OH — Kw=10-14;
H+ + OH — Kw=10-14;
CH3COOH H+ + CH3COO — Ka=1.8×10-5 。
H+ + CH3COO — Ka=1.8×10-5 。
(5)醋酸钠水解的平衡常数Kh的表达式为
(6)0.5mol·L-1醋酸钠溶液的pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液的pH为n,水解的程度为b。则a与b的关系为a b(填“大于”“小于”或“等于”)。
(7)0.9mol.L-1醋酸钠溶液中氢氧根离子的浓度为2.2×10-5mol·L-1 。在某溶液中含Mg2+、Cd2+ 、Zn2+ 三种离子的浓度均为0.01mol·L-1,向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,则能生成的沉淀化学式为
已知:Ksp[ Mg(OH)2 ]=1.8×10-11、Ksp[ Zn(OH)2 ]=1.2×10-17 、Ksp [ Cd(OH)2 ]="2.5" x 10-14 。
某反应中反应物与生成物有: 、
、 、
、 、
、 、
、 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目: +
+ +
+  →
→ + Br2+
+ Br2+  + H2O
+ H2O
(2)反应中,被还原的元素是,还原剂是。
(3)根据上述反应可推知。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: >Br2 d.还原性:
>Br2 d.还原性: > Br2
> Br2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥NaOH⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
氧化物 |
电解质 |
|||
| 属于该类的物质 |
② |
⑧ ⑨ |
⑦ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-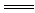 H2O,该离子反应对应的化学方程式为。
H2O,该离子反应对应的化学方程式为。
(3)⑩在水中的电离方程式为 ,
,
1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为。
(4)少量的④通入⑥的溶液中反应的离子方程为 。
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
试回答下列问题:
(1)平衡时CO的转化率为,该反应的化学平衡常数为。
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将(填“增大”、“减小”、“不变”),预计CO的转化率为。
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H0(填“>”、“=”、“<”)。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) ==CO2(g)△H1<0①
途径II:先制成水煤气:C(s) +H2O(g) ==CO(g)+H2(g)△H2>0②
再燃烧水煤气:2CO(g)+O2 (g) ==2CO2(g)△H3<0③
2H2(g)+O2 (g) ==2H2O(g)△H4<0④
则△H1、△H2、△H3、△H4的数学关系式是。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。
(2)烧杯间填满碎纸条的作用是。
(3)要重复进行三次实验的目的是。
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是_______。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”)。
(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ |
终止温度 T2/℃ |
温度差 △t/℃ |
||
| HCl |
NaOH |
平均值 |
|||
| 1 |
25 |
25 |
27.3 |
||
| 2 |
25 |
25 |
27.4 |
||
| 3 |
25 |
25 |
28.6 |
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C="4.18" J/(g·℃),则实验测得的中和热为。