瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气探究其性质,据此回答下列问题: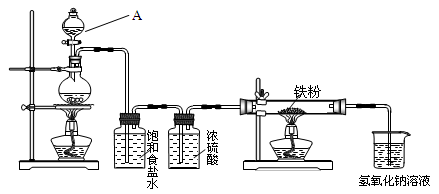
(1)A仪器的名称是 。
(2)上述制备氯气的化学反应方程式为_________________________________________,反应中浓盐酸被还原和未被还原的物质的量之比为_________。
(3)浓硫酸的作用是 ,烧杯中发生反应的离子方程式为
,作用是 。
(4)为探究铁与氯气反应的产物,某小组同学提出如下设想:
①产物只有FeCl3;②产物只有FeCl2;③ 。
甲同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果未出现血红色,再滴加氯水,出现血红色,得出结论为②是正确的;
乙同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果出现血红色,则产物中必含FeCl3。
请问上述观点错误的是 ,原因是 。
(用化学方程式或离子方程式和文字说明)
下表是元素周期表的一部分,请回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 四 |
⑧ |
⑨ |
(1)在这些元素中,最活泼的非金属元素是 (元素符号),原子最外层达到稳定结构的元素是(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是(填化学式);
(3)写出③、④的最高价氧化物对应的水化物相互反应的化学方程式
;
(4)③、⑥、⑧的原子半径由大到小为﹥﹥(填元素符号),
①、⑤的最高价含氧酸酸性﹥(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式;
(6)写出工业上制备⑤单质的化学方程式。
写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)图中所给数据进行分析,该反应的化学方程式为。
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=。
(3)当反应进行到第min,该反应达到平衡。
| A |
|||||||||||||||||||||||||
| B |
C |
D |
E |
F |
|||||||||||||||||||||
| G |
H |
I |
|||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||
(1)在上面元素周期表中全部是金属元素的区域为 。
(A)a(B)b(C)c(D)d
(2)G元素与 E元素形成的化合物中阴阳离子个数比为1:1的物质的化学式是 ,
表格中九种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是 ,酸性最强的是 (用化合物的化学式表示,下同),属于两性氢氧化物的是 。
(3)C、D、E、F四种元素中,气态氢化物稳定性最差的物质的空间结构为 。
(4)G、H两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。(填编号)
(a)看那种原子失去的电子越多,金属性越强。
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
现有①NaCl②干冰③冰④Na2O2⑤白磷⑥硫磺⑦MgCl2⑧金刚石⑨NH4NO3⑩SiO2十种物质,按下列要求回答:
(1)以上物质中属于原子晶体的是。
(2)既有离子键又有共价键的是。
(3)熔化时不需要破坏化学键的是。