对于任何一个平衡体系,采取以下措施,一定使平衡发生移动的是( )
| A.加入一种反应物 | B.增大体系的压强 |
| C.升高温度 | D.使用催化剂 |
将铁片加到2L0.5mol/LFeCl3溶液中,当Fe3+和Fe2+的浓度相等时,铁片的质量减少了
| A.2.8g | B.5.6g | C.11.2g | D.1.4g |
某学生设计了如图的方法对A盐进行鉴定: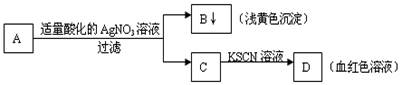
由此分析,下列结论中,正确的是()
| A.A中一定有Fe3+ | B.C中一定有Fe3+ |
| C.B为AgI沉淀 | D.A一定为FeBr2溶液 |
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是()
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
③不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
| A.① | B.②③ | C.② | D.①②③ |
X(盐)和Y(酸)反应,可放出有气味的气体Z;Z跟NaOH反应又得到X(盐);Z氧化的最终产物为W,W溶于水又得到Y(酸).则X(盐)和Y(酸)是
| A.Na2S和稀硫酸 | B.Na2SO3和盐酸 | C.Na2S和盐酸 | D.Na2SO3和稀硫酸 |
下列说法正确的是()
①非金属氧化物一定不是碱性氧化物②金属氧化物一定是碱性氧化物
③电解质的电离需要通电④Fe(OH)3、FeCl2、CaSiO3都能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
| A.①②④ | B.①④⑤ | C.①④ | D.全部 |