下列说法正确的是( )。
| A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 |
| B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 |
| C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) |
D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+)=c(CO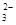 ),且c(Mg2+)·c(CO ),且c(Mg2+)·c(CO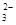 )=6.82×10-6 )=6.82×10-6 |
水的电离过程为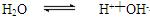 ,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述中正确的是
,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述中正确的是
| A.c(H+)随着温度升高而降低 | |
B.在35℃时,纯水中c(H+)﹥c(OH-) |
C.水的电离度a(25℃)﹥a(35℃) |
| D.水的电离过程是吸热反应 |
氢镍电池是近年开发出来的可充电电池,可以取代会产生隔污染的镉镍电池。氢镍电池的总反应式 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2,根据此反应式判断,下列叙述中正确的是
Ni(OH)2,根据此反应式判断,下列叙述中正确的是
| A.电池放电时,电池负极周围溶液pH不断增大 | B.电池放电时,镍元素被氧化 |
| C.电池充电时,氢元素被氧化 | D.电池放电时,H2是负极 |
能正确表示下列化学反应的离子方程式是
| A.用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2=SO32-+H2O |
| B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| C.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑ |
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是
| A.υ(H2)="0.1" mol·L-1·min-1 |
| B.υ(N2)="0.2" mol·L-1·min-1 |
| C.υ(NH3)="0.15" mol·L-1·min-1 |
| D.υ(H2)="0.3" mol·L-1·min-1 |
X、Y、Z、W 4块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W ® Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断 4种金属的活动顺序是
4种金属的活动顺序是
| A.X>Z>W>Y | B.Z>X>Y>W |
| C.X>Y>Z>W | D.Y>W>Z>X |