对于 0.1 mol/L Na2SO3溶液,正确的是( )
| A.升高温度,溶液 pH 降低 |
B.c(Na+)=2c(SO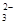 )+c(HSO )+c(HSO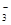 )+c(H2SO3) )+c(H2SO3) |
C.c(Na+)+c(H+)=2c(SO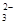 )+2c(HSO )+2c(HSO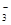 )+c(OH-) )+c(OH-) |
D.加入少量 NaOH 固体,c(SO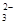 )与c(Na+)均增大 )与c(Na+)均增大 |
下列反应的离子方程式正确的是
A. |
B.用FeC13溶液腐蚀电路板: |
C.向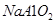 溶液中通入过量 溶液中通入过量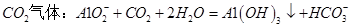 |
D.用食醋除去水瓶中的水垢: |
关于元素及其化合物,下列说法正确的是
| A.C12具有氧化性,故可以做漂白剂 |
| B.Na、A1、Fe三种单质在一定条件下与水反应都生成H2和对应的碱 |
| C.将浓硝酸、浓硫酸露置在空气中,两溶液的质量均增大、浓度均减小 |
D.将表面有铜绿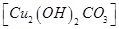 的铜器放入盐酸中浸泡,可除去铜绿 的铜器放入盐酸中浸泡,可除去铜绿 |
汽车剧烈碰撞时,安全气囊中发生反应: 。则下列判断错误的是.
。则下列判断错误的是.
| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
下列叙述正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.不慎将硫酸沾在皮肤上,立刻用干布擦净,然后用氢氧化钠溶液冲洗 |
| C.实验室配制一定物质的量浓度的溶液,定容时仰视刻度线,所配制溶液浓度偏大 |
| D.某溶液中加入BaC12溶液,产生了不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
下列有关结构和性质的说法正确的是
A.元素铯的两种核素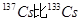 多4个质子 多4个质子 |
| B.P、S、C1得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.元素原子的最外层电子数越多,越容易得电子 |
| D.从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱 |