(本题15分)
I.已知:反应
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH =" —184" kJ/mol

(1)H2与O2反应生成气态水的热化学方程式是 。
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为: .
,它所对应的化学方程式为: .
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
| T/K |
300 |
400 |
500 |
… |
| K/(mol·L-1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。 
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系
为 。
向由Cu、Cu2O和CuO组成的混合物中,加入10 mL 6 mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu2O与稀硝酸反应的离子方程式。
(2)产物中硝酸铜的物质的量为。
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为,CuO的物质的量为。
A、B、C为短周期元素,它们的位置关系如下图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
(1)A、B、C的元素符号分别为:A_____、B_______、C____。B在周期表中的位置_______。
(2)C的离子结构示意图为_________,A的氢化物分子式为_________;
(3)B、C的最高价氧化物的水化物的酸性由强到弱的顺序为,比较B、C氢化物稳定性的强弱是。
[化学一有机化学基础](13分)对羟基扁桃酸是合成香料的重要中间体,它可由如下反应合成: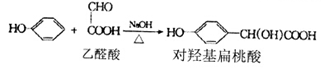
已知:
没有 —氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH
—氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH  CH3OH+HCOONa
CH3OH+HCOONa
(1)对羟基扁桃酸的分子式______________,乙醛酸分子中一种含氧官能团的名称________。
(2)写出一种满足下列三个条件的对羟基扁桃酸的同分异构体结构简式________________。
a.属于甲酸酯b.含酚羟基c.含亚甲基(一CH2一)
(3)苯酚能与甲醛发生聚合反应生成酚醛树脂,写出酚醛树脂的结构简式________________。
(4)对羟基扁桃酸不能发生的反应类型有_____________________________(填选项)。
| A.加成 | B.消去 | C.加聚 | D.取代 |
(5)写出乙醛酸发生康尼查罗反应的化学方程式_____________________________________.
[化学一物质结构与性质](13分)钛被称为“国防金属’’和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是_______________________________,钛所在的周期中第一电离能最小的元素是______________________________.
(2)金红石(TiO2)的熔点 ,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
(3)TiCl4能与NH4CI反应生成配合物(NH4)2[TiCl6]。此配合物中,形成配位键时提供孤对电子的有_____________.(填元素符号),空间构型呈正四面体的微粒是___________。
(4)TiO2+与H2O2在稀酸中反应生成橘红色的[TiO(H2O2) ] 2+离子,可用于钛的定性检验。
[TiO(H2O2) ] 2+中不含有_____________________________.
A.极性键
B.非极性键
C.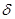 键
键
D. 键
键
E.离子键
(5)H2O2分子可看成H2O分子中的一个H被OH所取代,下列关于H2O2的说法正确的是______
A.H2O2分子结构对称为非极性分子
B.I mol H2O2最多能形成2mol氢键
C.H2O2不稳定是因为氢键的键能较小
D.H2O2分子的空间构型为直线形
(15分)卤素的单质及其化合物在生产、生活中应用广泛。
(1)“碘盐"通常是在食盐中添加适量的K1O3,为缺碘地区人们提供碘元素。
①碘元素的一种原子含74个中子、5 3个质子,表示此核素的符号是___(如 )。
)。
②“碘盐"溶液用稀硫酸酸化后,再加入淀粉碘化钾溶液,溶液由无色变篮色。
写出该反应的化学方程式__________________________________________。
③碘单质溶解在有机溶剂___________中形成常用的医用消毒剂(填结构简式)。
(2)工业上利用氢气和氯气反应制取盐酸,设计成原电池又能获取电能,下列说法错误的是___(填选项)。
| A.两极材料可用石墨,用稀盐酸做电解质溶液 |
B.通氯气的电极反应式为 |
| C.电解质溶液中的阳离子向通氯气的电极移动‘ |
| D.通入氢气的电极为原电池的正极 |
(3)H2和卤素单质(F2、C12、Br2、12)反应生成I molHX的能量变化如图所示(反应物和产物均为298K时的稳定状态)。
①曲线A代表的卤化氢是__________(填化学式)。
②写出Br2(1)与HCI气体反应的热化学方程式___________。
③往甲乙两容器分别通入等量的H2和I2,两容器起始状态相同,甲为恒容绝热密闭容器,乙为恒容恒温密闭容器,发生反应 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。