在一定温度下,将等量的气体分别通入起始体积相同的密闭容器I(恒容)和Ⅱ(恒压)中,使其发生反应,t。时容器I中达到化学平衡,x、Y、z的物质的量的变化如图所示,则下列有关推断正确的是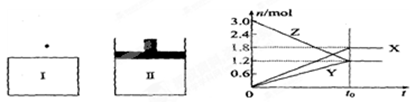
A.该反应的化学方程式为 |
| B.若两容器中均达到平衡后,两容器的体积V(I)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t。 |
| C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
| 选项 |
物质 |
除杂试剂 |
分离方法 |
| A |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
| B |
甲烷(乙烯) |
酸性KMnO4溶液 |
洗气 |
| C |
苯(苯酚) |
浓溴水 |
过滤 |
| D |
乙醇(乙酸) |
NaOH溶液 |
蒸馏 |
下列实验能获得成功的是
| A.将乙醛滴入银氨溶液中,加热煮沸制银镜 |
| B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量硫酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素 |
| C.向浓苯酚中加几滴稀溴水观察到沉淀 |
| D.取2mL 1mol·L-1CuSO4溶液于试管中,加入10mL 2mol·L-1NaOH溶液,在所得混合物中加入40%的乙醛溶液,加热得到砖红色沉淀 |
有机物结构理论中有一个重要的观点:有机物分子中原子间或原子团间可以产生相互影响,从而导致化学性质的不同,以下的事实不能说明此观点是
| A.ClCH2COOH的酸性比CH3COOH酸性强 |
| B.丙酮分子(CH3COCH3)中的氢原子比乙烷分子中的氢原子更易发生卤代反应 |
| C.HOOCCH2CHO既能发生银镜反应又能发生酯化反应 |
| D.苯酚能与NaOH溶液反应而乙醇则很难 |
下列离子方程式正确的是
| A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.氯乙酸与足量的氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO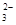 |
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O |
星际空间存在着以分子形式存在的星际物质。下表列出了某些星际分子发现的年代,下列有关说法正确的是
| 发现年代 |
1971年 |
1976年 |
1977年 |
1978年 |
1982年 |
| 星际分子 |
氰基乙炔(HC3N) |
氰基丁二炔(HC5N) |
氰基己三炔(HC7N) |
氰基辛四炔(HC9N) |
氰基葵五炔(HC11N) |
A.五种氰基炔互为同分异构体
B.五种氰基炔互为同系物
C.HC11N 属于高分子化合物
D.分子中三键个数的两倍与碳原子个数的差值为1