酸HX的下列性质中,可以证明它是弱电解质的是 ( )
| A.1 mol/L HX溶液的pH值约为2 |
| B.HX能与水以任意比例互溶 |
| C.10 mL 1mol/L HX恰好与10 mL l mol/L NaOH溶液完全反应 |
| D.HX溶液的导电性比强酸溶液的弱 |
下列溶液中,与100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50ml 1mol/L NaCl溶液 | D.25ml 0.5mol/L HCl溶液 |
在无色、碱性溶液中能大量共存的一组离子是
| A.Ca2+、Na+、SO42-、MnO4- | B.K+、Fe2+、SO42-、HCO3- |
| C.Ba2+、K+、Al3+、Cl- | D.Na+、Ba2+、Cl-、NO3- |
化学与日常生活密切相关,下列说法错误的是
| A.碘酒是指单质碘的乙醇溶液 |
| B.84消毒液的有效成分是NaClO |
| C.浓硫酸可刻蚀石英制艺术品 |
| D.装饰材料释放的甲醛会造成污染 |
氧化还原反应与四种基本反应类型关系如图,下列化学反应属于区域3的是 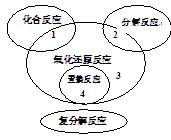
| A.Zn+H2SO4==ZnSO4+H2↑ |
B.3CO+Fe2O3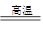 2Fe+3CO2 2Fe+3CO2 |
| C.CaO+H2O==Ca(OH)2 |
D.CaCO3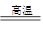 CaO+CO2↑ CaO+CO2↑ |
下列叙述中,正确的是
| A.标准状况下,Cl2的摩尔质量为71g |
| B.氧化还原反应一定有氧元素参加 |
| C.标准状况下,1molCCl4的体积是22.4L |
| D.Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |