物质A—E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000 mL,pH的变化如图l所示,其中A与D反应得到E。请回答: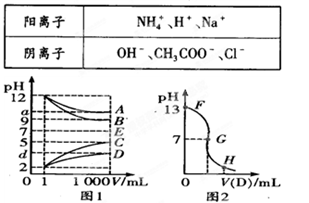
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B. ,D. 。
(2)图l中a>9的理由是 。
(3)另取浓度为C1的B溶液25 ml,向其中逐滴滴加0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为 。
②G点溶液呈中性,则加入D溶液的体积V (填“>”、“<’’或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC= 。
为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作: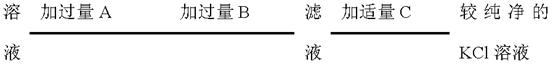
(1)写出三种试剂的化学式:A,B,C。
(2)加过量A的原因是
有关反应的化学方程式为:
(3)加过量B的原因是:
有关反应的化学方程式为:
有一包白色粉末,可能由KCl、BaCO3、BaCl2、KNO3、NH4NO3和Na2SO4中的一种或几种组成。现进行下列实验:
(1)将此粉末溶于水中,得到无色透明溶液A及白色沉淀B,过滤。
(2)取沉淀物B,加稀HNO3后,沉淀物B不溶解。
(3)取少量溶液A,加入适量的NaOH溶液,加热,产生无色有刺激性气味并能使湿润的红色石蕊试纸变蓝色的气体。
(4)再取少量溶液A,滴入AgNO3溶液,充分反应后,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此推断,该白色粉末中,一定含有,肯定不含有,可能含有。
NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是
洗涤沉淀的方法是。
在反应X+2Y=R +2M中,已知R、M的摩尔质量之比为22:9。当1.6gX与Y完全反应后,生成4.4gR,则在此反应中,Y、M的质量之比为________
+2M中,已知R、M的摩尔质量之比为22:9。当1.6gX与Y完全反应后,生成4.4gR,则在此反应中,Y、M的质量之比为________
将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________。