下列各物质投入水中,因促进水的电离而使溶液呈酸性的是
| A.NaHSO4 | B.Na3PO4 | C.CH3COOH | D.NH4Cl |
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
| A.CuCl2 | B.FeCl2 | C.FeCl3 | D.AlCl3 |
下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的一组是
| A.KOH和Al2(SO4)3 | B.稀H2SO4和NaHCO3 |
| C.CaCl2和Na2CO3 | D.Ba(OH)2和NaHSO4 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,11.2L氧气所含的原子数为NA |
B.17g的NH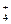 离子中含有的电子数为NA 离子中含有的电子数为NA |
| C.常温常压下,48gO3含有的氧原子数为3NA |
| D.24g金属镁变为镁离子时失去的电子数为NA |
下列数量的各物质所含的原子数按由大到小顺序排列正确的是
①0.5molNH3②标准状况下22.4L氦气(He)③4℃时9mL水④0.2molNa3PO4
| A.①③④② | B.①④③② | C.④③②① | D.②③④① |
可用离子方程式H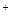 +OH
+OH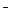 =H
=H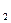 O表示的化学反应是
O表示的化学反应是
A.CH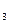 COOH+NaOH=CH COOH+NaOH=CH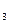 COONa+H COONa+H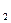 O O |
B.2HNO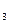 +Mg(OH) +Mg(OH)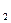 =Mg(NO =Mg(NO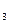 ) )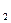 +2H +2H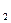 O O |
C.H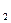 SO SO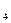 +Ba +Ba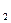 (OH) (OH)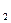 =BaSO =BaSO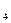 ↓+2H ↓+2H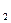 O O |
D.2HCl+Ba(OH)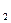 =BaCl =BaCl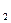 +2H +2H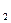 O O |