为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 、 。
(3) 完成并配平下列离子方程式:
C2O42++ MnO4—+ H+ = CO2+ Mn2++
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+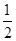 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。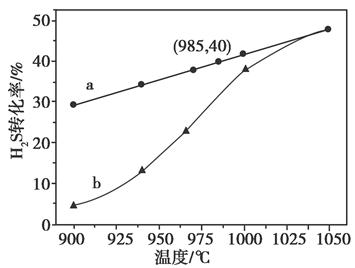
②电化学法
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。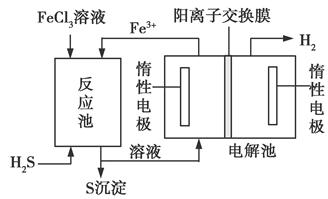
Fe(OH)3胶体在生活中有重要应用,利用FeCl3和沸水反应制备的Fe(OH)3胶体中常混有FeCl3和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
(1)实验室制取Fe(OH)3胶体的方法是________,用________方法除去胶体中的浑浊物;根据________现象证明胶体已经制成。
(2)检验溶液中存在Fe3+和H+的方法是__________________________________________
(3)除去胶体中混有的FeCl3和HCl的方法是:_________________________________。
(4)如何用实验的方法证明胶体和Cl-已经分离?___________________________。
(5)鉴别Fe(OH)3胶体和FeCl3溶液最简单的方法是_________________________________。
(6)高铁酸钠(Na2FeO4)的氧化性比KMnO4更强,它是一种备受关注的新型净水剂,请指出Na2FeO4净水的原理,并说明该净水剂有何优越性_______________________________________。
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是__。
(2)检验溶液B中是否存在Fe3+的方法是__。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度/(mol·L-1) |
盐酸物质的量浓度/(mol·L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=__mol·L-1;从第②组情况表明,c__(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+)__(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序__>__>__>__(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小。
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在如图所示元素周期表(局部)中的相应位置上。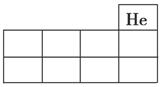
(2)X的最高价氧化物对应水化物的稀溶液与铜反应的化学方程式为。
(3)一定条件下,1 mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为__。
Ⅱ.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是__(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250 mol·L-1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。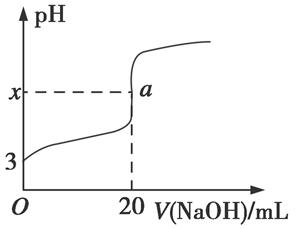
其中,a点表示两种物质恰好完全反应。
①图中x(填“>”“<”或“=”)7。
②室温时,HR的电离常数Ka=(填数值)。
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)n(HSO3-)变化关系如下表:
| n(SO32-)n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
(1)由上表判断NaHSO3水溶液显__性,原因是__。
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是__。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为21,则滴入盐酸中n(HCl)为__mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为__,再加入1.0 mol CO后,重新达到平衡,CO的转化率__(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数__(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+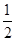 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
有关键能数据如下:(单位:kJ/mol)
| 化学键 |
H—H |
H—O |
C—H |
C—O |
C=O |
| 键能 |
435 |
463 |
413 |
356 |
745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式:__。