(原创)元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前四周期的一部分)列出了①~⑧八种元素在周期表中的位置。
| |
|
|
|
|
|
| |
|
① |
② |
③ |
|
| ④ |
⑤ |
|
⑥ |
⑦ |
|
| |
|
|
|
⑧ |
|
请回答:
(1)②所代表元素的名称为 ,原子结构示意图为 ,在周期表中的位置为 。
(2)八种元素中,金属性最强的元素是 (填元素符号),最高价氧化物的水化物酸性最强的是 (填化学式),最高正化合价与最低负化合价的代数和为4的元素是 (填元素符号)。
(3)⑦和⑧的原子序数相差 ,请写出一个能证明非金属性⑦>⑧的离子方程式: 。
(4)②、④、⑥所对应元素中原子半径最小的是 (填元素符号),简单离子半径最大的是 (填离子符号)。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。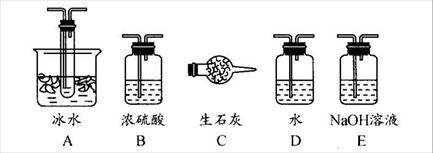
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是。
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
图1 (图中表示生成1mol物质时的能量)图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀 较
完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的
溶度积常数Ksp=4×10-38)
粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+ 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2 + 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2 + 5CO2↑②
SiO2 + Na2CO3→ Na2SiO3 + CO2↑③
(1)粉煤灰中铝的质量分数为% 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) = x,消耗Na2CO3y mol,试确定y与x的关系式。
用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺,现对某印刷电路生产厂家蚀刻绝缘板后所得的混合溶液(标记为A)进行如下分析:
①取50.0mL A溶液加入足量的硝酸银溶液,析出沉淀86.1g
②取50.0mL A溶液试探性地加入1.12g铁粉,结果全部溶解未见固体析出
③向实验②所得溶液中加入50 mL稀硝酸,产生1.12L NO(标准状况),反应后所得溶液的pH为1。
结合上述信息计算:
(1)所得沉淀的物质的量_____________mol;
(2)该厂所使用的FeCl3溶液的物质的量浓度_____________mol/L;
(3)A溶液中Cu2+的物质的量浓度。
已知:①NaNO2具有强氧化性
②
奥沙拉秦是一种抗菌药。其合成路线如下:
(1)写出下列反应的化学方程式:
水杨酸→A_________________________________________________________;
A→B __________________________________________________;
(2)写出D的结构简式______________________;
(3)写出下列反应的反应类型:D→E______________,F→奥沙拉秦___________;
(4)从整个合成路线看,设计B→C步骤的作用是___________________________;
(5)F的结构简式为___________________;
(6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________