I、现有Ag某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________ ________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________________mol/L。
II、(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:
KIO3 + 5KI + 3H2SO4 ="=" 3K2SO4 + 3I2 + 3H2O
如果反应中转移0.2mol电子,则生成I2的物质的量为_________________mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)。若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量可高达 35.0%,钙含量为50%。它可以用CaCO3通过下列步骤方便地制出:
(1)已知固态二元化合物D中钙含量为62.5%,则D的化学式为。
(2)请推算出A的化学式。。
(3)分别写出上述过程中生成D和A的化学方程式。 ;。
(4) 将A放入水中,会重新生成CaCO3并放出刺激性气味的气体,请写出发生反应的化学方程式。。
(5)已知CaCO3与CaSO4的溶度积分别为2.8×10—9、9.1×10—6。由此可知二者的溶解度的大小关系为CaCO3CaSO4。在锅炉除垢操作中,要先用碳酸钠溶液将水垢中的硫酸钙转化成为碳酸钙。其主要原因是 。
。
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: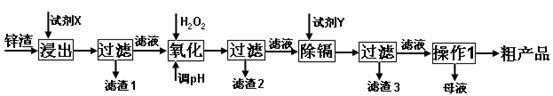
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为(填名称)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是(填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)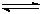 CH3OH(g)。图1表
CH3OH(g)。图1表 示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。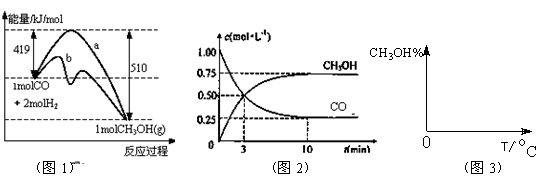
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于(填:吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡, v(H2)=____ ____;该温度下CO(g)+2H2(g) 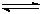 CH3OH(g)的化学平衡常数为______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
(16分)从樟科植物枝叶提取的精油中含有甲、乙两种成分:
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):
反应I的反应类型为,Y的结构简式。
(3) 1mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式。
(14分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。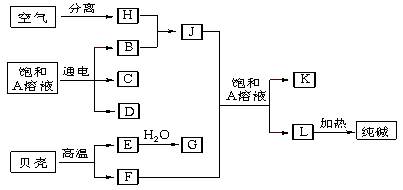
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式:。
(2) 电解A溶液反应的离子方程式为___________________________________。
若该反应中转移电子数为8NA,则产生的氯气 在标准状况下体积为L
在标准状况下体积为L
(3) J分子的空间构型为____________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:____________________。