炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: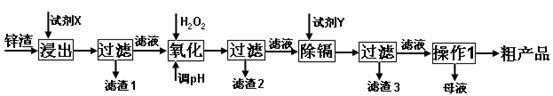
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为 (填名称)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是 (填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是 。