某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)上述反应的化学方程式为 。
(2)已知NaH2PO2水溶液pH>7,次磷酸是 元(填“一”、“二”或“三”) (填“强”或“弱”)。次磷酸的电离方程式为: ;NaH2PO2水溶液pH>7的原因: 。
(3)25℃时,向100mL0.01mol∙L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积 (填“>”、“=”或“<”)100ml。此时溶液中离子浓度由大到小的顺序是 。
过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有(写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是(填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是。
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是,Z是;
(2)Z、W两溶液中水的电离程度由大到小的顺序为(用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢,B分子中碳碳键的键长有两种。以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示。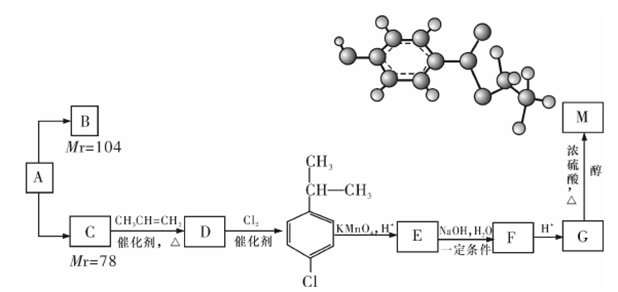
(1)B能使溴的四氯化碳溶液褪色,则B的结构简式为。
(2)C→D的反应类型为。
(3)写出E→F的化学方程式。
(4)G中的含氧官能团的名称是,写出由G反应生成高分子的化学反应方程式。
(5)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:。
①能发生银镜反应
②含有苯环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1 mol该有机物与足量的钠反应生成1 mol氢气(一个碳原子上同时连接两个—OH的结构不稳定)
现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为_____________________
(2)上述四种元素的原子半径由大到小的顺序为__________________(用元素符号表示)
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为_____________________
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为_____________________________
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是: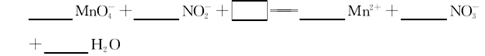
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是(填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。