(12)【物质结构与性质】A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、C、D可形成常见的气态单质,A、E最外层电子数与其电子层数相等。B、F同主族,B元素基态原子核外电子平均分布在3个不同的能级上。C元素原子的最高能级上有3个未成对电子。F的一种单质与FD2晶体类型相同。
(1)A分别与B、F形成的最简单化合物相比较,影响沸点高低的主要作用力是 。
(2)写出D的基态原子的核外电子排布式:___________________。
(3)B、C、D的第一电离能由小到大的顺序为: 。
(4)BD2在高温高压下所形成的晶胞如图所示,该晶体中B原子的杂化方式为__________。

(5)由上述5种元素中的1种或几种形成的,与C的单质互为等电子体的物质是 (填化学式)。
(6)在E的化合物E2Cl6中存在的化学键有 。
a.共价键
b.非极性键
c.配位健
d.σ键
e.π键
现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A); (B);(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是;电解质溶液是。
②写出电极反应式:负极;正极。
③若导线上转移电子1mol,则负极质量变化g。
已知在一定条件下,2mol H2完全燃烧生成液态水时放出热量572kJ,请回答下列问题: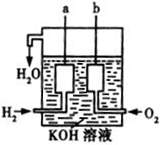
(1)反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量。
(2)在此条件下,若反应生成含1molO-H键的液态水,则放出热量为kJ;若2 mol氢气完全燃烧生成水蒸气,则放出的热量(填“>”、“<”或“=”)572 kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成,一极通入H2 ,另一极通入O2,则(填物质化学式)失电子作负极;正极电极反应式为:;电池总反应为:。
W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是;
淡黄色固体F中含有的化学键是。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为: 。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为:。(用化学式表示)
下表是元素周期表的一部分,针对表中①~⑩中的元素,回答以下问题:
| ① |
|||||||||||||||||||||||||
| ② |
③ |
④ |
⑤ |
||||||||||||||||||||||
| ⑥ |
⑦ |
⑧ |
⑨ |
||||||||||||||||||||||
|
|
|
⑩ |
||||||||||||||||||||||
(1)在表中a、b、c、d四个区域中,全部是金属元素的区域为 。
(2)在①~⑨元素中,原子半径最大的是 (填元素名称);①和③组成的化合物的电子式为 ;⑨的离子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式,下同),碱性最强的是 ,呈两性的是 。
(4)⑨和⑩中,非金属性较强的是 (填元素符号);可用一个化学反应说明该事实,写出该反应的离子方程式: 。
(1)人类的生活和生产活动,可以说都离不开能源。在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是;属于“不可再生能源”的是。(填序号)
(2)甲、乙两种金属: ①甲单质能与乙盐的溶液反应;②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙;③分别与氯气反应生成金属阳离子时,甲失去电子数比乙多;④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气。其中一定能说明甲的金属性比乙强的有。(填序号)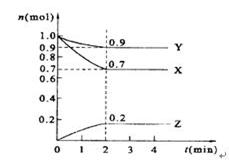
(3)某温度时,在2 L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示。由图中所给数据进行分析,该反应的化学方程式为;反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=;反应达到平衡时,Y的浓度为。