自来水厂的水源水(原水)通常含有各种杂质,必须经过去除固体杂质和悬浮物、消毒、去除异味等一系列净化工序(即净化过程),才能达到使用标准。
(1)原水净化有下列措施:①过滤,②添加混凝剂,③加入活性炭,④加入消毒剂。你认为正确的顺序是 ;
| A.①②③④ | B.②①③④ | C.②③①④ | D.④①②③ |
(2)原水中可以加入明矾作为混凝剂,从而达到去除固体杂质和悬浮物,其原理是明矾溶于水后生成的胶体可以吸附水中的悬浮颗粒并使之沉降。写出明矾中的Al3+水解生成胶体的离子方程式________________________________________________;
(3)目前我国不少自来水厂采用液氯消毒,液氯注入水中与水发生可逆反应,生成一种强酸和一种弱酸(次氯酸),该反应的化学方程式为______________________________。
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体2.016升(标准状况),该气体通过盛有红热CuO粉末的硬质玻璃管,发生反应:CH4+4CuO CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
(1)原混合气体中CH4的物质的量为________mol;
(2)原混合气体中N2的体积分数为________。
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
| 阴离子 |
SO42-、NO3-、Cl- |
| 阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显现象;
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变;
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题:
(1)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象是________________;实验中中所发生反应的离子方程式是_________________________;
(2)原溶液中所含阳离子是(写离子符号)___________________.
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是________________g。
氯气和氮氧化物都是重要的化工原料,但进入大气后,都对环境造成污染。
【Ⅰ】已知:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+ 8 H2O,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。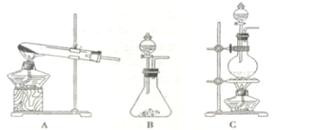
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式:。
(3)常用NaOH溶液吸收氯气防止污染。写出该反应的离子方程式。
【Ⅱ】已知:NO2+NO+2NaOH=2NaNO2+H2O,可用氢氧化钠溶液可以吸收废气中的氮氧化物。
(1)在该反应中,氧化剂是。
(2)汽车尾气中含有一氧化氮和一氧化碳,经过排气管中的催化转化器转化为对大气无污染的物质。写出该反应的化学方程式:。
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3 kJ。写出该反应的热化学方程式。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别
通入乙烷和氧气。通入乙烷气体的电极应为极(填写“正”“负”)该电极上发生的电极反应
式是
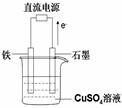
(3)如图所示实验装置中,石墨棒上的电极反应式为;如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 __________(填物质名称)。