下列对如图所示装置实验判断的描述正确的是( )
| |
a电极 |
b电极 |
X溶液 |
实验判断 |
| A |
Cu |
Zn |
H2SO4 |
H+向b极迁移 |
| B |
Zn |
Fe |
H2SO4 |
a、b极都放出无色气体 |
| C |
Al |
Mg |
NaOH |
a为负极,b为正极 |
| D |
Cu |
石墨 |
FeCl3 |
a极质量减小,b极质量增加 |

液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) 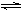 NH3(g) + HI(g)
NH3(g) + HI(g)
b.2HI(g) 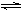 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向(填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化(填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 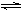 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据: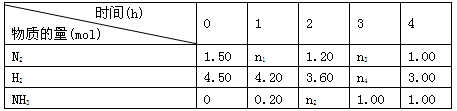
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因。
合成氨反应为:N2(g)+3H2(g)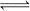 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
下列说法正确的是
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是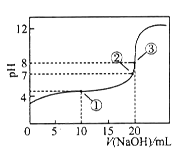
| A.①点所示溶液的导电能力弱于②点 |
| B.图中点③所示溶液中,c(CH3COO-)<c(Na+) |
| C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D.滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+) =c(OH-)的关系存在 |
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是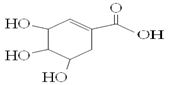
| A.分子式为C7H6O5 |
| B.分子中含有2种官能团 |
| C.可发生加成和取代反应 |
| D.1mol莽草酸与足量金属Na反应生成生成0.5mol H2 |
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是
| A.X元素最高价氧化物对应水化物的酸性弱于Y元素的 |
| B.Y元素气态氢化物的稳定性大于Z元素的 |
| C.M和Y两种元素,可以形成电子层结构相同的两种简单离子 |
| D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应 |