M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。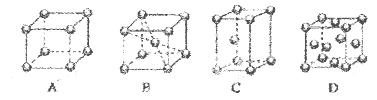
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3•6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2•H2O和C、[M(H2O)4Cl2]Cl•2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮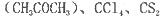 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物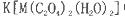 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。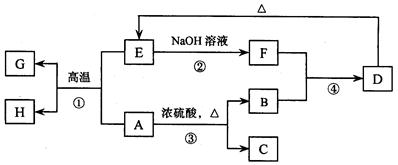
请填空:
(1)H的名称是。
(2)E的两种用途是、。
(3)反应③的化学方程式是。
(4)反应④的离子方程式是。
(1)下列有机物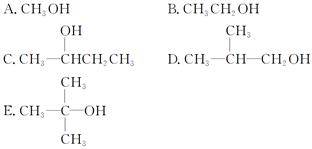
其中能被氧化成醛的有______________,不能被催化氧化的有____________,可发生
消去反应的有____________
(2)有机物A为茉莉香型香料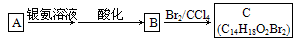
①A分子中含氧官能团的名称是____________.
②C的分子结构可表示为(其中R和R′代表不同的烃基):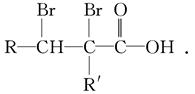
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂.请按要求填空: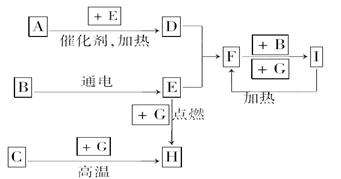
(1)写出下列物质的化学式:
A:________;B:________;C:________.
(2)写出F+B―→I的化学方程式_______________________________.
(3)写出G和I的浓溶液反应的化学方程式______________________________________.
(1)下图为某市售盐酸试剂瓶标签上的部分数据.问: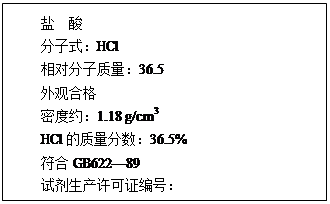
该盐酸的物质的量浓度为多少?(列式计算)
(2) 已知锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。请回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
①硫酸铝和氢氧化钠②硫酸铝和氨水
③硫酸锌和氢氧化钠④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式.。
(1) 已知下列变化过程中,0.2 mol RxO42—参加反应时,共转移0.4 mol电子.
RxO+MnO4—+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2) 在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
(3)要使含a mol Al3+的A溶液中铝元素和含有b mol AlO2—的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)