已知物质A分子式为C3H4O2,显酸性。F为由七个原子组成的环状结构,分子式为C6H8O4。请根据以下框图回答问题:
(1)A的结构简式为________________________________。
(2)反应①的反应类型为__________________________。
(3)化合物B中含氧官能团的名称是______________________________。
(4)D和E生成F的化学方程式__________________________________。
D和E按照1:1反应也可生成高聚物,请写出生成该高聚物的化学反应方程式=______
________________________________________________________________________。
(5)G生成H的化学方程式________________________________________________。
(6)写出C的同分异构体中属于酯类物质的结构简式_______________________、
________________________、____________________________________(至少写3个)
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.10 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式。
②上述反应T1℃时的平衡常数K1=。
③根据上述信息判断,温度T1和T2的关系是(填序号)。
a.T1>T2 b.T1<T2 c.无法比较
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。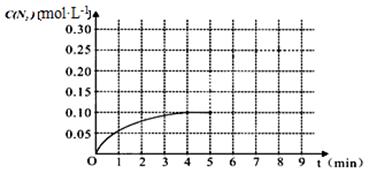
①计算从反应开始到平衡时,平均反应速率v(N2)=。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
在阳极区发生的反应包括和H ++ HCO3- ="=" H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) +  O2(g) ="==" H2O(g)Δ H1= —242 kJ·mol-1
O2(g) ="==" H2O(g)Δ H1= —242 kJ·mol-1
CH3OH(g) +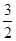 O2(g) ="==" CO2 (g) + 2 H2O(g)Δ H2= —676 kJ·mol-1
O2(g) ="==" CO2 (g) + 2 H2O(g)Δ H2= —676 kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是(填字母序号)。
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为(填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为。
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为。
(2)用“>”、“<”或“=”填空
| 离子半径 |
酸性 |
还原性 |
得电子能力 |
| N3-Al3+ |
H2SO4HClO4 |
O2-S2- |
35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是()(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2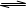 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率。该反应K值将。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是(填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是。
已知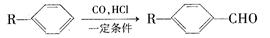
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: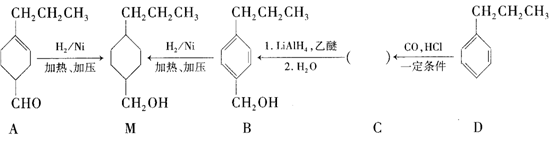
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物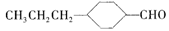 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。