浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
| A.绿色变深 | B.浅绿色变得更浅 | C.变黄 | D.无明显变化 |
下列说法不正确的是()
| A.反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能储存起来 |
| C.吸热反应中由于反应物总能量小于生成物总能量,因而无利用价值 |
| D.物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是()
| A.甲醇 | B.天然气 | C.液化石油气 | D.氢气 |
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是()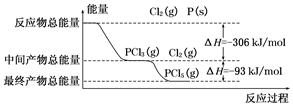
| A.其他条件不变,升高温度有利于PCl5的生成 |
| B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ/mol |
| D.其他条件不变,对于2PCl5(g)=2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小 |
已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是()
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于()
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |