海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室
里从海藻中提取碘的流程如下图:
(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式:
________________________________________________________________________。
(2)灼烧海带用到的硅酸盐仪器有
________________________________________________________________________。
(3)提取碘的过程中,可供选择的有机试剂是( )
| A.酒精 | B.四氯化碳 |
| C.甘油 | D.醋酸 |
主族元素A、B、C、D、E的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体F。此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。E的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水。回答下列问 题:
题:
⑴写出元素符号A, C 。
。
⑵E元素的最高价氧化物和盐酸反应的离子方程式为:。
⑶用电子式表示F的形成过程。 在加热的条件下B、D形成的化合物的电子式为,其中的化学键的类型为。
在加热的条件下B、D形成的化合物的电子式为,其中的化学键的类型为。
⑷写出一种有A、B、C、D组成的化合物的化学式。
(5)B的气态氢化物是天然气的主要成分,它的空间结构为。
新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有性。
现有常见金属A、B,它们之间存在如下的转化关系(图中有些反应的产物和反应的条件没有全部标出),其中G、H为白色沉淀。请回答下列问题: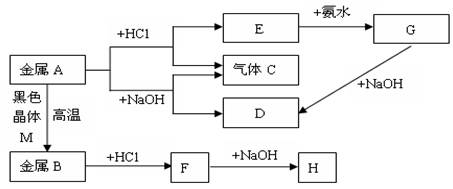
(1)写出金属A和物质D的名称或化学式:、。
(2)写出E转化为G的离子方程式;
(3)写出H放在空气中的现象:。
在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题: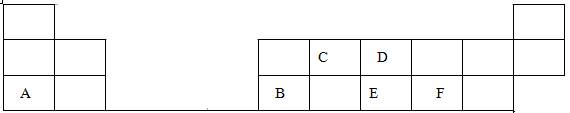
(1)画出D的原子结构示意图;
(2)写出C的最高价氧化物的电子式;
(3)E和F分别形成的气态氢化物中最稳定的是(填写氢化物的化学式)
(4)A最高价氧化物的水化物的化学式。
根据硝酸和硫酸所具有的性质,选择适当的字母按要求填空。
| A.吸水性 | B.脱水性 | C.强氧化性 | D.强氧化性和酸性 |
(1)浓硫酸常用作干燥剂,说明浓硫酸具有;
(2)用玻璃棒蘸浓硫酸滴在纸上,发现变黑,说明浓硫酸具有;
(3)浓硫酸和浓硝酸都可以与铜反应,反应中浓硫酸和浓硝酸显示出;