按要求填空:
(1)常温下将0.1molCO2气体通入1L 0.2mol·L-1NaOH溶液中,测得混合溶液的pH=12,则混合溶液pH=12的原因是(用离子方程式表示) ,混合溶液中由水电离出的c(H+) 0.2mol·L-1NaOH溶液中由水电离出的c(H+)。(填“>”或“<”或“=”)
(2)常温下若将0.2mol·L-1MOH溶液与0.1mol·L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”或“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH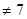 ,则HR的电离方程式为 。
,则HR的电离方程式为 。
(4)常温下将0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,已知溶液中c(Na+)>c(CN﹣),则该混合溶液中的pH____7(填“>”或“<”或“=”),c(HCN)+c(CN﹣)=______mol/L。
(5)常温下,0.1mol/L的某一元酸HA在水中的电离度为0.1%(电离度是指溶液中已电离的溶质分子数占原有溶质分子总数的百分率),则该溶液的pH= ,HA的电离平衡常数K= 。
(6)水的电离平衡如右图所示。若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为 ;将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。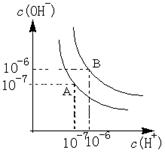
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l) ΔH=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H=kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为;反应达到平衡后,升高温度,此时平衡常数将(填“变大”、“不变”或“变小”),平衡将向(填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是。
| A.增大的CO浓度 | B.增大的H2O(g)浓度 | C.使用催化剂 | D.降低温度 |
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
在实验室中严禁打闹,某几个同学在做实验中打闹而同时把盛有浓盐酸和盛固体KClO3的试剂瓶打破,使其在地上混合立即产生大量黄绿色气体,发生反应的化学方程式为:
KClO3+ 6HCl(浓) KCl+3Cl2↑ + 3 H2O
KCl+3Cl2↑ + 3 H2O
(1)该反应中的氧化剂是___________。
(2)在化学方程式上标出电子转移的方向和数目。
(3)如反应中转移了0.50 mol电子,则产生的气体在标准状况下体积为________ L 。
(4)在清除碎片时某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液 ②NaCl溶液 ③KBr溶液 ④NaHCO3溶液. 正确选择是(填试剂号数).
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO、Cl-、NO等离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
试推断:
(1)该溶液中一定存在______________,一定不存在________________。
(2)上述溶液中至少有__________、_________(填化学式)等物质混合而成;其物质的量比为。 (3) 写出图中a b变化过程的离子方程式。
(3) 写出图中a b变化过程的离子方程式。
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称 ,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者后者(填>、<或=)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为:
。
(3)现有以下物质:①NaCl晶体②熔融的KNO3③氨水④铝⑤Cl2⑥酒精(C2H5OH)
请回答下列问题(用序号):
以上物质中能导电的是 ;以上物质中属于强电解质的是。
(4)SiO2广泛存在自然界中 ,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学
,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学 反应方程式
反应方程式
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为:;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为。
(4)E核外电子排布式是,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有