乙酸乙酯可以做白酒勾兑用香料、人造香精。实验室制乙酸乙酯的主要装置如图7所示,主要步骤:①在a试管中按3∶2∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按图7连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出乙酸乙酯。(加热装置略)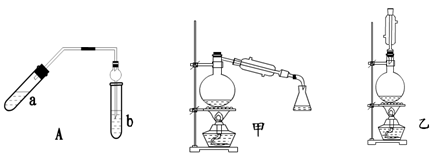
图7 图8 图9
请回答下列问题:
(1)步骤①中,配制混合溶液的正确操作是 。
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用 。(填字母)
a. 降低乙酸乙酯的溶解度
b. 除去实验中挥发出来的硫酸
c. 除去乙酸乙酯中混有的乙酸和乙醇
(3)图7装置中使用球形干燥管除起到冷凝作用外,另一重要作用是 ,步骤⑤中分离乙酸乙酯必须使用的一种玻璃仪器是 。
(4)为充分利用反应物,提高乙酸乙酯产量,甲、乙两位同学分别设计了图8和图9两种装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为效果较好的是 。
(5)若实验中用CH3CH218OH的乙醇与乙酸(CH3COOH)作用,此反应的化学方程式为 。
(9分)下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题。
(1) 元素④的原子结构示意图是。
(2) 元素③与⑥形成的化合物中的化学键类型为。元素①与⑤形成的化合物的电子式为。
(3) 在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式);这三种元素最高价氧化物对应水化物中碱性最强的是(填写化学式);
(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”),它们的气态氢化物中稳定性最弱的是(化学式)。
(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方。写出该反应的化学方程式。

根据图示填空:
(1)化合物A含有的官能团是。
(2)1mol A与2 mol H2反应生成1mol E,其反应方程式是。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是。由E生成F的反应类型是。
Ⅰ.已知:
(烃基烯基醚)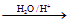
烃基烯基醚A的相对分子质量(
)为176,分子中碳氢原子数目比为3∶4 。与
相关的反应如下: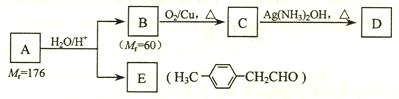
请回答下列问题:
⑴
的分子式为。
⑵
的名称是;
的结构简式为。
⑶写出
→
反应的化学方程式:。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:、。
①属于芳香醛;②苯环上有两种不同环境的氢原子。
Ⅱ.由
转化为对甲基苯乙炔(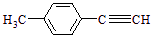 )的一条路线如下:
)的一条路线如下: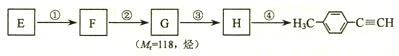
⑸写出
的结构简式:。
⑹写出反应所加试剂、反应条件:反应②反应③
(7)写出反应类型:反应①;反应④
按下图装置进行实验,并回答下列问题
⑴判断装置的名称:A池为__________池,B池为___________池。
⑵铜极为__________极,电极反应式为,
石墨棒C1为______极,电极反应式为________________________,
石墨棒C2附近发生的实验现象为______________________________。
⑶当C2极析出224mL气体(标准状态)时,左侧烧杯中溶液的质量_________(增加、不变或减少)_________g。
(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式_____________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+1/2O2(g)===H2O(l )ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式。