为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。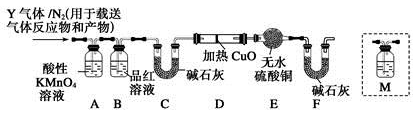
(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)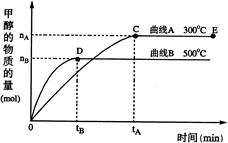
根据题意完成下列各题:
(1)该反应正向为ΔH0;其熵变ΔS0(选填“<”或“>”)。
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,则下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d .重新平衡时n(H2)/n(CH3OH)增大
.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:________________________________ _(用化学方程式表示)。
_(用化学方程式表示)。
(1)实验室在配制AgNO3的溶液时,常将AgNO3固体溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度而不是直接溶于水中,原因是(用离子方程式表示):;
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
回答下列有关常数的问题
(1)Kw的数学表达式是Kw=,温度升高Kw的变化情况是(选填“变大”、“变
小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越,对于反应2NO2(g)  N2O4(g),其化学平衡常K的数学表达式为
N2O4(g),其化学平衡常K的数学表达式为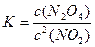 ,式中c2(NO2)表示的意义是。
,式中c2(NO2)表示的意义是。
(3)Ka通常表示弱酸的电离平衡常数,α通常称为电离度。对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是(选填“变大”、“变小”或
“不变”),α的变化情况是(选填“变大”、“变小”或“不变”)。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2 型共价化合物和C2A 型离子化合物。由上述条件回答下列问题:
(1) A、B、C三元素的元素符号分别是:A_______,B_______,C_______。
(2) 化合物C2A的电子式是_______(3)化合物BA2的化学式是:_______
写出下列物质或微粒的电子式(每空1分)
(1) CaCl2(2)CO2(3) KOH
(4) HF(5) Na2O2(6) N2
(7) 镁离子(8)硫离子(9)NH4Cl_________ (10) Cl2____________________