已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>C>D | B.离子半径:C>D>B>A |
| C.原子序数:D>C>B>A | D.单质的还原性:A>B>D>C |
已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是()
3C(g)+D(s)(正反应为放热反应),图2-28中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是()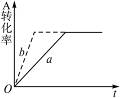
图2-28
| A.增大A的浓度 | B.扩大容器的容积 |
| C.加入催化剂 | D.升高温度 |
在一定温度下将CO和水蒸气各1 mol放在密闭容器中反应:CO+H2O CO2+H2,达平衡后测得CO2为0.6 mol。再通入4 mol水蒸气,达到新的平衡后,CO2的物质的量为()
CO2+H2,达平衡后测得CO2为0.6 mol。再通入4 mol水蒸气,达到新的平衡后,CO2的物质的量为()
| A.0.6 mol |
| B.1 mol |
| C.>1 mol |
| D.0.6 mol<n(CO2)<1 mol |
某一达到化学平衡状态的可逆反应:mA(g)+nB(g) pC(g)+qD(g),如图2-27表示A的转化率α(A)同温度、压强的关系。分析该图示可以得出的结论是()
pC(g)+qD(g),如图2-27表示A的转化率α(A)同温度、压强的关系。分析该图示可以得出的结论是()
图2-27
A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
在可逆反应中,加入催化剂的作用是()
| A.改变正、逆反应速率,但改变的程度不同 |
| B.提高反应物达到平衡时的转化率 |
| C.缩短到达平衡所用的时间 |
| D.提高生成物在平衡体系中的质量分数 |
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2 (g) 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均增大变为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是()
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均增大变为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是()
| A.0.16 | B.0.08 |
| C.0.04 | D.0.02 |