下面是四位同学在学习了化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是( )
| A.化学反应速率理论可指导我们如何在一定时间内快出产品 |
| B.化学平衡理论可指导我们如何使用有限原料多出产品 |
| C.化学反应速率理论可指导我们如何提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
下列实验操作中错误的是
| A.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计的水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应用酒精灯将溶液蒸干 |
| D.称量时,应将砝码放在托盘天平的右盘上 |
保护环境是每一个公民的责任和义务。下列做法中,有利于保护环境的是
①在农田中焚烧植物秸秆②城市生活垃圾分类处理③推广使用燃煤脱硫技术,防治SO2污染④限制使用一次性塑料购物袋⑤集中掩埋废旧电池
| A.①②③ | B.②③④ | C.①②⑤ | D.①④⑤ |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 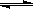 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡移动了 |
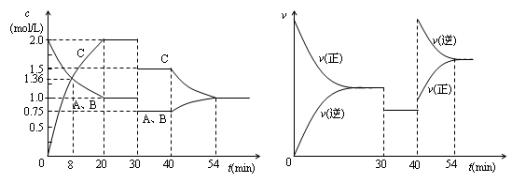
下列化合物中既易发生取代反应,也可发生加成反应,还能使KMn04酸性溶液褪色的是
| A.乙烷 | B.乙醇 | C.丙烯 | D.苯 |
下图有关电化学的示意图正确的是
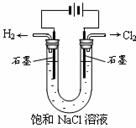
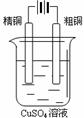
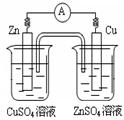
A. B. C. D.