在25℃时,将2个铜电极插入到一定量的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol结晶水合物Na2SO4·10H2O,另有一定量蓝色沉淀产生。若保持温度不变,则所剩溶液中溶质的质量分数是
A.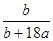 |
B. |
C.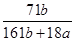 |
D.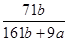 |
用惰性电极电解下列溶液,在阴、阳两极生成气体的体积比为1∶1的是( )
A. 溶液 溶液 |
B.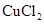 溶液 溶液 |
C. 溶液 溶液 |
D. 溶液 溶液 |
将金属钠分别投入下列物质的稀水溶液中,能生成白色沉淀的是
| A.HCl | B.K2SO4 | C.MgCl2 | D.CuCl2 |
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
①分子中含有7个碳原子的芳香烃 ②分子中含有4个碳原子的烷烃 ③分子中含有12个氢原子的烷烃④分子中含有8个碳原子的烷烃( )
| A.①② | B.②③ | C.③④ | D.②④ |
生铁和钢的主要区别是()
| A.生铁和钢的主要成分都是铁,但二者的含碳量不同,性能也不同。 |
| B.生铁和钢都是碳的合金 |
| C.生铁就是含杂质较多的钢,钢就是含杂质较少的生铁。 |
| D.生铁是混合物,钢是纯净物 |
高温下丁烷完全裂化生成四种气体,将混合气体用溴水处理后,剩余气体的平均分子质量为21.6,则原四种混合气体的平均分子质量是
| A.21.6 | B.27.6 | C.29 | D.36.4 |