某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子。
①取10 mL。该溶液于试管中,滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀。
②取10 mL。该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的物质的量的变化关系如右图所示。下列说法不符合事实的是
| A.根据图示数据计算实验中使用的NaOH溶液的物质的量浓度为1 mol/L |
| B.根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1 mol/L |
| C.另取一定量该溶液滴加一定量Ba(OH)2的溶液,能使Al3+和SO42-同时完全沉淀 |
| D.NH4+、K+、Al3+、SO42-四种离子的物质的量之比为2:1:1:3 |
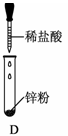
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 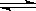
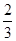 Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
①增加Fe2O3的量②移出部分CO2③提高反应温度④减小容器的容积 ⑤加入合适的催化剂 ⑥降低反应温度
| A.①③ | B.②⑥ | C.②④ | D.④⑥ |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: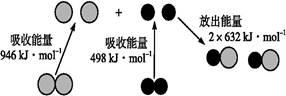
下列说法中正确的是
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列说法正确的是
| A.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| B.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
下列说法或表示法正确的是
| A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石)△H="+1.19" kJ/mol可知,石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
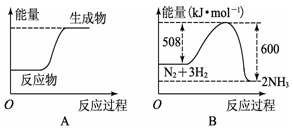
下列图示变化为吸热反应的是