以H2O2、熔融盐Na2CO3组成的燃料电池来电解制备N2O5,装置如下图所示,其中Y为CO2。下列说法错误的是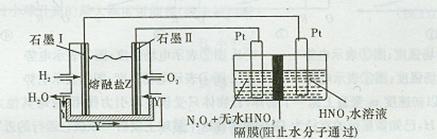
| A.石墨Ⅱ电极上发生反应的电极反应式为:O2+4e一十2CO2=2CO32- |
| B.在电解池中生成N2O5的电极反应式为:N2O4+2NO3一-2e一=2N2O5 |
| C.放电时熔融盐中CO32-向石墨I电极方向移动 |
| D.每消耗11.2 L(标准状况)氢气,理论上可以制得108 g N2O5 |
下图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
| A.浓H2SO4 |
| B.饱和NaCl溶液 |
| C.浓NaOH溶液 |
| D.浓NaBr溶液 |
不能用离子方程式: +2H+====CO2↑+H2O来表示的反应是
+2H+====CO2↑+H2O来表示的反应是
| A.碳酸钡和盐酸 |
| B.碳酸氢钾和H2SO4 |
| C.碳酸钠与硝酸 |
| D.碳酸铵与盐酸 |
实验室制Cl2的反应为4HCl(浓)+MnO2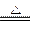 MnCl2+C12↑+2H2O。下列说法错误的是
MnCl2+C12↑+2H2O。下列说法错误的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 mol Cl2,转移电子的物质的量为2 mol |
| C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol |
| D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
| A.1∶1 | B.2∶1 | C.1∶2 | D.2∶3 |
下列各种环境下的离子组能大量共存的是
A.pH=1的溶液中:K+、Fe2+、Cl-、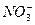 |
B.强碱性溶液中:Na+、K+、[Al(OH)4]-、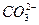 |
C.中性溶液中:Na+、Ca2+、Cl-、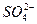 |
D.使蓝色石蕊试液变红的溶液中: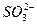 、 、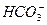 、Na+、K+ 、Na+、K+ |