【化学——选修3:物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 种;写出Cu+的核外电子排布式: 。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有 ,属于d区的元素有 种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,发生的原因是 。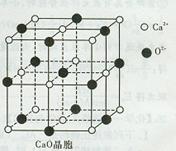
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是 (填字母序号)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为 ,CNO-的中心原子的杂化方式为 。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6一n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R- H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为 。
(8分)同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为;同质量的氨和硫化氢气体的体积比为,其中含有的氢的原子个数比为;若二者氢原子数相等,它们的体积比为。
(1)室温下PH=2的某强酸稀释100倍,PH=_____,PH=12的某强碱稀释100倍,PH=____
(2)室温下,PH=2的HCl与PH=12的氨水等积混合后,溶液的PH_ __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________
(3)室温下,0.01mol/L的HCl与0.01mol/L的氨水混合后,溶液的PH___7(填>,<或=),原因是_______________________________________________________________________
(4)室温下,将PH=5的H2SO4溶液稀释10倍C(H+):C(SO42-)=_________
将稀释后的溶液再稀释100倍,C(H+):C(SO42-)=_________
(5)MOH和ROH两种一元碱的水溶液分别加水稀释时,PH变化如右图:下列叙述中正确的是()
A:MOH是一种弱碱
B:在x点,MOH完全电离
C:在x点C(M+)=C(R+)
D:稀释前ROH溶液中C(OH-)是MOH溶液中C(OH-)的10倍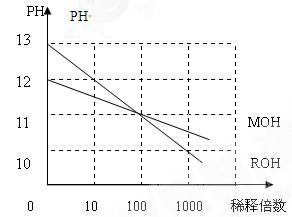
在一定体积的密闭容器中,进行反应CO2(g)+ H2(g)  CO(g)+ H2O(g)。其平衡常数K和温度T的关系如表所示:
CO(g)+ H2O(g)。其平衡常数K和温度T的关系如表所示:
| T/℃ |
70 0 0 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________________
(2)该反应为______反应(填“吸热”或“放热”)
(3)能判断该反应达化学平衡状态的依据是____
A:容器中压强不变 B:混合气体中C(CO)不变
C:V(H2)正=V(H2O)逆D:C(CO2)=C(CO)
(4)某温度下,平衡浓度符合下式:C(CO2) ·C(H2)=" C(CO)" ·C(H2O)试判断此时的温度__________________
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2) 为2 mol/L ,C(H2)为1.5 mol/L ,C(CO) 为1mol/L, C(H2O)为3 mol/L,则此时刻反应向____(填“正向”或“逆向”)进行
在室温下,下列五种溶液①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③ 0.1mol/ L NH4HSO4④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液⑤0.1mol/LNH
0.1mol/ L NH4HSO4④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液⑤0.1mol/LNH 3·H2O
3·H2O
(1)溶液①呈___性(填“酸”“碱”或“中”)其原因是____________________________(用离子方程式表示)
(2 )比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
)比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
(3)在溶液④中,_____________离子的浓度为0.1mol/L
NH3·H2O和_________离子的物质的量浓度之和为0.2mol/L
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度_______(填>,<或=")" NH4+的水解程度,C(CH3COO-)_________C(NH4+)(填>,<或=)
(1)5.7g汽油(主要成分为C8H18,相对分子质量为114)完全燃烧生成液态水和CO2,放出275.9KJ的热量,则汽油的燃烧热为_______________
(2)已知:2H2(g)+ O2(g)=2H2O(g)△H="-483.6" KJ/mol
H2O(l)= H2O(g)△H="+44" KJ/mol
a):写出H2与O2反应生成液态水时的热化学方程式_________________________________
b):在通常情况下,若要得到857.4KJ的热量,需H2的质量为____,这些H2在标况下的体积为______.