A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②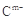 、
、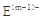 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)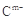 、
、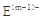 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:_____________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是 。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为___________________________________________
(2)锰粉经浓盐酸浸取,过滤Ⅰ除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是____________________________________________________________。
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是___________________________________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为_____________________________________________。
(5)实验室进行过滤操作时,需要用到的玻璃仪器有________________________
分析下面两个案例并回答有关问题。
(1)某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。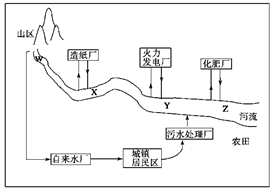
| 地点 项目 |
W |
X |
Y |
Z |
| 水温/℃ |
15 |
18 |
26 |
25 |
| pH |
6 |
8 |
5 |
5 |
| 溶解氧量/(mg·L-1) |
11 |
9 |
7 |
3 |
①导致X、Y处水样pH变化的原因可能是_______________________________
②Z处鱼类大量减少,产生这种现象的原因可能是_______________________
(2)某地区已探明蕴藏着丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成有规模的工业体系。据此确定上图中相应工厂的名称:
A________、B________、C________、D________;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式_____;
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可)______________________________________________________________
在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重,这种材料难分解、处理麻烦,最近研制的一种可降解塑料,代号为3HB,结构简式为 具有良好的生物适应性,能在自然界降解。请回答下列问题:
具有良好的生物适应性,能在自然界降解。请回答下列问题:
(1)该可降解塑料在自然界中可通过________(填序号)反应降解为该聚合物的单体
| A.加成 | B.消去 | C.水解 | D.氧化 |
(2)该聚合物的单体的结构简式为_________________________________________,
该单体中具有的官能团的名称为______________。
(3)各取1 mol该单体分别与钠和碳酸氢钠溶液完全反应时,分别消耗钠和碳酸氢钠物质的量之比为________。
在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有四座工厂:甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。
请完成下列问题:
(1)四座工厂排出的废液里含有的污染物质是:
甲______________,乙______________,丙____________,丁____________。
(2)在丁的下游某处取出的河水,肯定含有的离子是______________________。
(3)小河中鱼、虾几乎绝迹的原因是____________________________________
2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:______________________
________________________________________________________________________。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1mol HClO2发生分解反应时,转移的电子数是_____________________________________________________。
(3)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是______________。
| A.MnO2 | B.KMnO4溶液 |
| C.稀盐酸 | D.Na2SO3溶液 |