滴定法是科研和生产中测定溶液中物质浓度的常用方法。
(1)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl—的浓度, [Ksp(AgCl) =1.56×10—10,Ksp(Ag2CrO4)=1.10×10—12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②已知该滴定适宜的酸度范围是pH 6.5~10.5,且当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl—及时释放出来,防止滴定终点提前
(2)氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72—,实验数据记录如下:
 实验数据 实验数据实验序号 |
FeSO4溶液体积读数/mL |
|
| 滴定前 |
滴定后 |
|
| 第一次 |
0.10 |
16.20 |
| 第二次 |
0.30 |
15.31 |
| 第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72—+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
(8分) 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它能发生如下反应:3NF3+5H2O===2NO+HNO3+9HF。请回答下列问题:
⑴NF3中氮元素的化合价为;
⑵NF3的大于HNO3(填氧化性或还原性);
⑶在上述反应中还原剂与氧化剂的物质的量之比为;
⑷若生成0.2 mol HNO3,则转移的电子数为;
10分)写出下列反应的离子方程式
⑴电解饱和食盐水
⑵铝与氢氧化钠溶液反应
⑶碳酸氢钠溶液中滴入少量的氢氧化钙溶液
⑷加热次氯酸钠浓溶液与浓盐酸的混合液
⑸在溴化亚铁溶液中通入过量的氯气
、近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。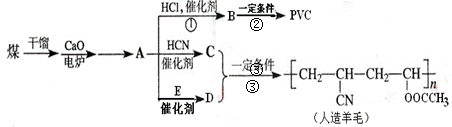
请回答下列问题:
(1)A的结构中含有三键,写出A的结构式,
写出B和PVC的结构简式
(2)写出反应类型反应①反应②。
(3)反应③中C、D两种单体按…CDCDCD…方式加聚,D的结构为CH2=CHOOCCH3,写出C的结构简式。
(4)写出D与氢氧化钠溶液共热时发生的化学反应方程式。
利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题: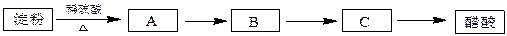
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、淀粉水解:,反应。
II、B与醋酸反应:,反应。
Ⅲ、B→C:,反应。
(2)可用于检验淀粉水解是否产生A的试剂是。]
检验所酿的陈醋中是否含有淀粉的方法是。
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期中金属性最强的元素。回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为;L和M元素的离子半径大小顺序是(用离子符号表示)。
(2)Z、X两元素按原子数目比l∶3构成分子A,A的电子式为。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则硒的最高价氧化物的水化物化学式为。
(4)由X、Z、L三种元素组成的离子化合物与稀NaOH溶液共热可生成使红色石蕊试纸变蓝的气体,写出该反应的离子方程式:。
(5)写出由M、L元素组成的物质的电子式。