[化学--修2:化学与技术](15分)
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
(1) ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为 。缺点主要是产率低、产品难以分离,还可能污染环境。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_______________________。此法提高了生产及储存、运输的安全性,原因是_________。
三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。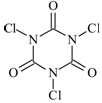
(1)利用三氯异氰尿酸水解产物中的氧化性物质X可消毒灭菌,X的分子式为。
(2)“有效氯”含量指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.5680 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1500 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点(发生反应的方程式为:2Na2S2O3+I2=Na2S4O6+2NaI);重复测定2次,所得的相关数据如下表:
| 滴定序号 |
待测液体积/mL |
标准液滴定管起点读数/mL |
标准液滴定管终点读数/mL |
| 1 |
25.00 |
0.06 |
24.04 |
| 2 |
25.00 |
0.02 |
24.02 |
| 3 |
25.00 |
0.12 |
24.14 |
①滴定终点观察到的现象为;
②配制0.1500 mol·L-1 Na2S2O3溶液100 mL,所需Na2S2O3·5H2O的质量为;
③计算此样品的“有效氯”含量(写出计算过程)。
碘海醇是一种非离子型X-CT造影剂。下面是以化合物A(分子式为C8H10的苯的同系物)为原料合成碘海醇的合成路线[R-为-CH2CH(OH)CH2OH]: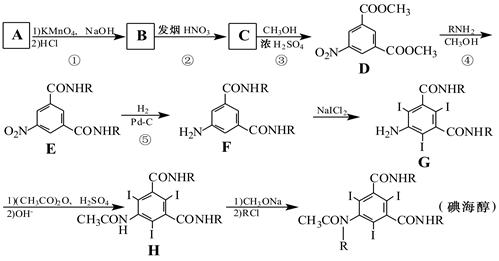
(1)写出A的结构简式:。
(2)反应①→⑤中,属于取代反应的是(填序号)。
(3)写出C中含氧官能团的名称:硝基、。
(4)写出同时满足下列条件的D的两种同分异构体的结构简式:。
Ⅰ.含1个手性碳原子的α-氨基酸;
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢;
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应。
(5)已知:
①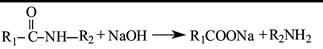
②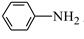 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以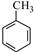 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体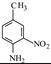 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:H2C=CH2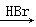 CH3CH2Br
CH3CH2Br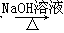 CH3CH2OH
CH3CH2OH
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为。
(2)“滤渣2”中主要成分的化学式为。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是。
(4)“电解”时用惰性电极,阳极的电极反应式为。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3;;。
水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI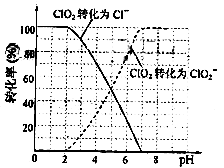
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的(填字母代号)。



a b c d e
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果。
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: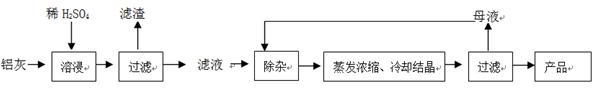
(一定条件下,MnO4 - 可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
2.7 |
| 完全沉淀时 |
5.2 |
9.7 |
3.2 |
(1)H2S04溶解A1203的离子方程式是
(2)检验滤液中还存在Fe2+的方法是(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:( Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的:;调节溶液的pH为3.2的目的是。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是,写出其反应方程式:;
③Ⅲ中加入MnS04的目的是。
(4)从多次循环使用后母液中可回收的主要物质是。(填化学式)